2023年7月13日,国家药监局药品审评中心(CDE)官网显示,苏州蓝马医疗技术有限公司(以下简称:蓝马医疗)LM103注射液(TILs)正式获得国家药品监督管理局(NMPA)的临床试验默示许可。
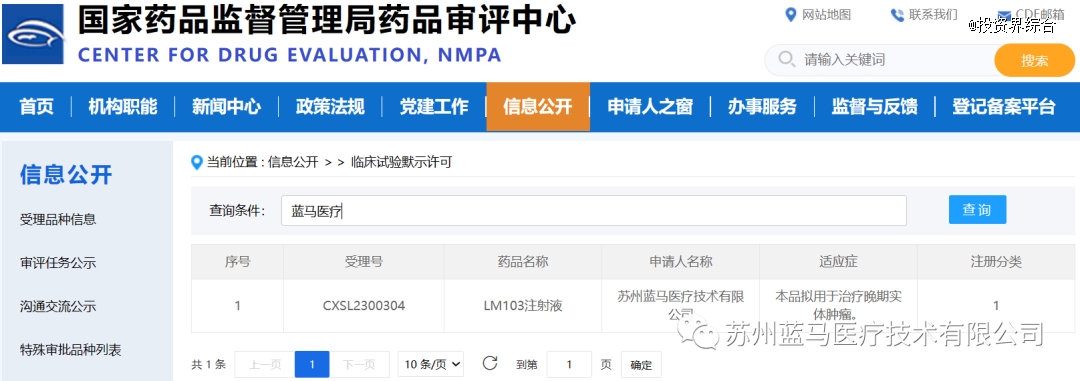
国内TILs领域*使用滋养细胞(以下简称:Feeder)工艺的临床许可
根据公开信息,TILs全球龙头Iovance Biotherapeutics(以下简称:Iovance),目前公布的所有临床数据都是基于使用滋养细胞(以下简称:Feeder)生产工艺制备的TILs,Feeder是保证TILs细胞质量和数量的关键工艺原材料。蓝马医疗利用自己的T-Feeder平台对Feeder的制备及其在TILs培养中的使用工艺进行了优化,有效缩短TILs培养制备时间,提高制备效率,同时通过严格的质控策略确保使用产品安全性,并通过研究者发起临床研究初步证明了采用Feeder工艺的TILs在临床上的安全性和有效性。
蓝马医疗遵循了包括Iovance在内的主流商业公司及癌症中心对于Feeder不可或缺性的共识,成为国内*家在工艺中使用Feeder生产工艺并获得临床许可的TILs企业,依靠其独特的工艺,确保TILs成品在细胞数量、细胞质量、制备成功率等多个关键指标上的优异表现,目前公司与Feeder相关专利已获得受理。
关于LM103注射液
蓝马医疗产品LM103注射液(TILs)通过蓝马医疗自有工艺开发,在满足最高可达细胞数量(>1X1011)、细胞活度(>90%)、最快扩增速度(22天工艺)及高扩增倍数(数千倍)等关键技术指标基础上,保证了稳定的制备成功率。得益于此,公司所开发LM103注射液对初始肿瘤体积小或穿刺来源组织的患者的TILs制备具备独特的技术优势,能为更多实体肿瘤患者提供治疗选择和服务。
TILs最新国际临床进展
2023年7月10日,Iovance Biotherapeutics宣布TILs疗法监管方面最新进展,在一次Type B三期临床前会议上,收到FDA反馈认可IOV-LUN-202的临床设计,作为加速批准的必要条件意味着LN-145作为PD-1抗体的后线治疗可能获得加速批准。这意味着IOVANCE两款核心TILs疗法产品上市都具备了很大确定性,如果Iovance Lifileucel获批,将成为*获批上市的实体肿瘤细胞治疗产品,具有里程碑意义。
关于蓝马医疗
苏州蓝马医疗技术有限公司(以下简称:“蓝马医疗”)成立于2020年12月,是一家位于苏州高新区,专注于开发以肿瘤浸润性淋巴细胞(TILs)疗法产品为核心的生物医药企业,细胞免疫治疗在国外恶性肿瘤治疗中已取得了显著的临床疗效,目前公司主要在研产品覆盖包括宫颈癌、非小细胞肺癌、恶性黑色素瘤、头颈肿瘤等在内的实体瘤种。
蓝马医疗创始人团队在TILs疗法研发和产业化方向深耕多年,其中包括来自MD安德森癌症研究中心TIL试验室等机构及进度*的商业化公司的资深科学家。从科研界到产业界,创始人团队在TILs疗法领域已经积累了近20年产品生产、质控及团队管理经验。
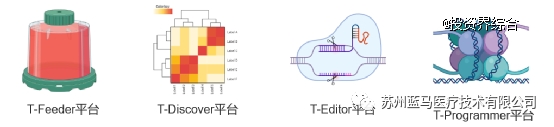
自成立以来,蓝马医疗已经搭建了四大技术平台,包括T-Feeder平台(基于滋养细胞的TILs生产工艺研发平台,保障了TILs能快速扩增至1010~11级别,且活率、表型、功能表现优异)、T-Discover平台(立足于临床样本的新靶点发现平台,有助于深入探究TILs疗法的MOA,为优化TILs的性质和功能提供了新靶点)、T-Editor平台(基因改造型TILs新产品的研发平台,通过基因编辑,对TILs的功能和性质进行优化,以进一步提高疗效)、T-Programmer平台(表观遗传重编程型TILs新产品的研发平台,使用低剂量表观遗传调控化合物,对TILs进行重编程,以获得更强更持久的抗肿瘤作用)。
未来,公司将继续秉持“高效、协作、正直、包容”的核心价值观,积极完成联合管线、基因修饰TILs等在内的产品管线,并努力致力于实现:“成为国内*的细胞治疗新药剂产业化研发平台”这一目标而努力。
Reference:
1: https://ir.iovance.com




