11月21日,先声药业宣布引进康乃德生物医药的IL-4Rα单抗Rademikibart大中华地区权益,康乃德生物医药有权获得1.5亿元人民币首付款+潜在最高8.75亿元人民币的里程碑及高达净销售额两位数百分比的特许权使用费。
同日,康乃德生物公布IL-4Rα单抗药物Rademikibart治疗中至重度AD(特应性皮炎)第二阶段临床的52周数据,达到了临床主要终点和次要终点。
有意思的是,买方和卖方走出了“极度撕裂”的走势。
康乃德11月21日当晚实现了巨额跌幅,截至收盘下跌38.83%;反观先声医药,则是在11月22日港股医药板块表现普遍较差的情况下,实现了2.03%的小幅上涨。
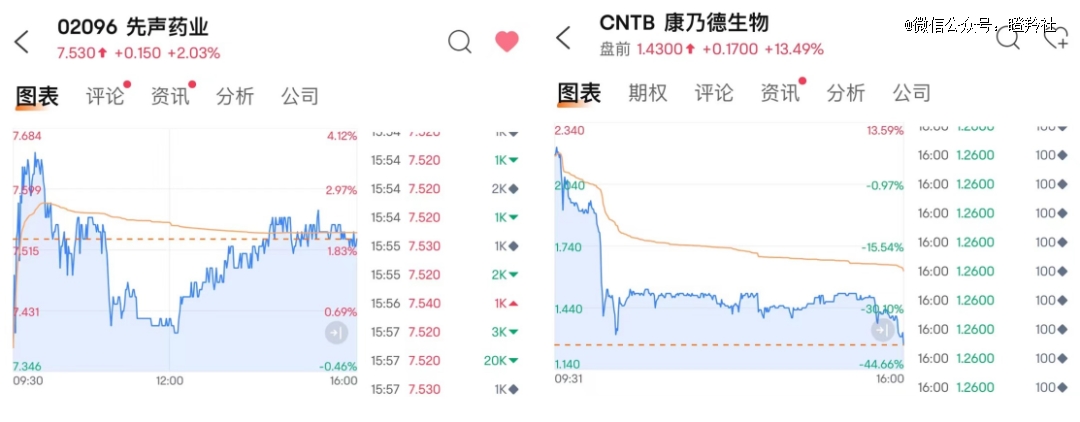
为何会出现这种状况?或许是中 美医药市场的环境差异,以及两地投资者的认知差异造就了这一结果。
01、Rademikibart数据走过一次鬼门关
众所周知,IL-4Rα单抗赛道上有赛诺菲的度普利尤单抗(Dupilumab)这座先发大山,在攻克了AD、COPD等适应症后,全球重磅炸弹之相展露无遗;在国内,除了度普利尤单抗之外,康诺亚的司普奇拜单抗(CM310)已经在近期提交了NDA,有望成为国产*IL-4Rα单抗;这意味着,康乃德的Rademikibart(CBP-201)需要拿出更好或者至少媲美的数据才能过关竞争。
康乃德的CBP-201并非没有过高光时刻。
CBP-201在I期临床试验的表现极为亮眼,在剂量同为300mg的情况下,使用CBP-201的患者,仅4周后全部达到了EASI-50(湿疹面积和严重程度改善超过50%)。而使用赛诺菲度普利尤单抗患者,在4周时只有69%的患者达到了EASI-50。由此,因为有成为度普利尤单抗的me-better产品,公司股价一度爬升超过29美元一股。
不过,在2021年底公司公布的临床IIb期第16周分析显示:300mg每两周(300 mg Q2W)EASI-75对比安慰剂为33.1%,EASI-90对比安慰剂为13.9%;300 mg Q4W EASI-75对比安慰剂为26.8%,EASI-90对比安慰剂为14.3%。
相比赛诺菲的度普利尤单抗临床数据,CBP-201从1期结果度普利尤单抗me-better的定位,瞬间掉落到了me-worse的境地,数据公布后公司股价实现了腰斩,市值一路下跌至1亿美元以内。
不过,从康乃德公布的CBP-201最新的一项临床数据显示:在一项纯基于中国人群的CNOO2试验中,其52周的长效数据获得了极大改善,Q2W和Q4W组的IGA 0/1分别为76.0%、87.2%,EASI-75分别为91.7%、91.9%。
CNOO2试验数据的“挽回”,这大概率也是先声药业愿意买下CBP-201大中华区权益的原因。
02、中 美市场差异
康乃德最新公布的CBP-201临床数据,尽管看到了一定长期疗效数据的内涵,但在16周数据的改善上弱于度普利尤单抗;另外,由于是非头对头的数据,相较于度普利尤单抗的52周数据,CBP-201并没有非常“显著”数据说明能够稳赢。
所以,CBP-201的me-too或者me-worse的标签,在美国市场投资者眼里并未逆转。同时,对于只有中国亚组的长效有效数据的CBP-201,其欧美等发达国家市场的价值已经被*程度削弱。
康乃德在经历小分子口服1-磷酸鞘氨醇受体1(S1P1)CBP-307的二期临床不顺后,公司已经将资源倾斜全力推进IL-4Rα单抗CBP-201的研发;截至2023年6月底,公司现金及现金等价物和短期投资已经来到了9.51亿人民币,若按照目前高强度的研发支出,预计现金支撑已经不足两年,而本次先声药业的1.5亿首付款,也是杯水车薪。
另一面,国内投资者看这笔先声药业和康乃德的交易或许有着截然不同的视角,中国亚组长效临床数据,较康乃德早前公布的16周数据有较好的改善,有概率能够在国内获批上市,这是“管线失败”到“可能国内上市”的预期转变。
即便康乃德的CBP-201是me-too药物,但在IL-4Rα单抗的进度上,康乃德仅次于康诺亚的CM310,从国内市场前三获批的药物而言,凭借先声医药强大的商业化能力(参照康宁杰瑞PD-L1的商业化),还是有望将该药物商业化取得一定成绩。
03、先声医药的算盘
对于先声药业来说,以较小的代价获得这样一个潜力产品,无疑是比较划算的,当然,也有很大赌的成份。
首先,先声药业预计瞄准了康诺亚CM310目前的NDA提交进度,根据常规的CDE审评周期,有不小的概率无法参与2024年的医保谈判,这意味着其很可能在2026年才正式进入医保。而康乃德的CBP-201计划在明年上半年提交NDA,如果顺利在2025年上半年获批,那么将和CM310在医保层面纳入同一起跑线。
其次,康乃德计划用CNOO2试验的数据来向CDE提交CBP-201的上市申请,尽管公司对外公布是注册性临床,但似乎这一项是二期试验(入组大约330人),预计要与CDE进行沟通;反观康诺亚的CM310,其三期临床入组大约500人,并早在2022年在AD适应症上被CDE授予了突破性疗法,又在近期被纳入优先审评(CBP-201则无类似标签),似乎更能获得CDE对其的认可。
在目前国内已有度普利尤单抗在市、CM310提交审评的背景下,CBP-201凭借比前两者更少患者的临床注册性二期提交NDA,无疑具有不小的风险,如果与CDE沟通不顺,可能需要补充入组患者,甚至需要再开三期。
不过,对于先声药业来说,以这样一个小的期权注码来获得康乃德最核心的管线,同时为自身的自免领域布局增添一种可能性,显然是有利的。
明年上半年,一切答案或许就能揭晓。
【本文由投资界合作伙伴微信公众号:瞪羚社授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






