8月12日早,广生堂发布公告:公司宣布完成乙肝治疗创新药GST-HG141慢性乙型肝炎低病毒血症二期临床试验并取得积极临床结果,将支持GST-HG141进一步开展三期确证性临床试验。
据公司公告称,GST-HG141具有与在市一线乙肝抗病毒药物不同的作用机制,属于全球*的潜在First-in-class项目,有望成为全球口服乙肝抗病毒治疗里程碑式的创新药。
受该消息影响,广生堂当日收涨20%,不过随后在第二交易日迅速回落,并未延续“类香雪制药”的走势。
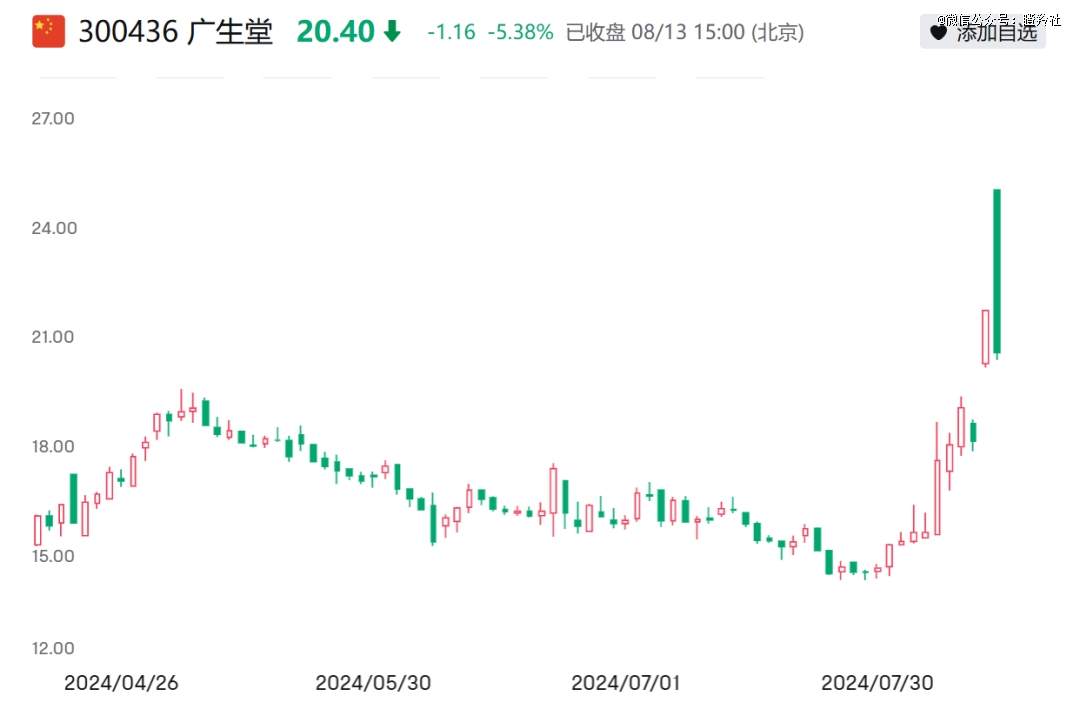
尽管广生堂未能给部分投资者带来短期持续的赚钱效应,但GST-HG141这类创新机制的药物潜力以及乙肝药物市场,仍然值得深度探讨与分析的价值。
01 乙肝治愈的难题
无论是国内还是全球范围内,治愈乙肝的需求存在巨大缺口。
数据显示,全球受乙肝和丙肝影响的有3.25亿人,每年导致140万人死亡。据估算,中国乙肝病毒感染者约8600万人,每年约33万人死于乙肝或丙肝感染导致的肝硬化和原发性肝癌,中国乙肝表面抗原携带者人数是全球最多。
慢性乙型肝炎患者如果不积极治疗发生肝硬化、肝癌的风险较高。长期抗乙肝病毒治疗可以阻止肝脏炎症,减轻甚至逆转慢性乙型肝炎引起的肝纤维化。
而抗乙肝病毒治疗在临床上有三个治疗里程碑:部分治愈、功能性治愈、彻底治愈(区别如下)。
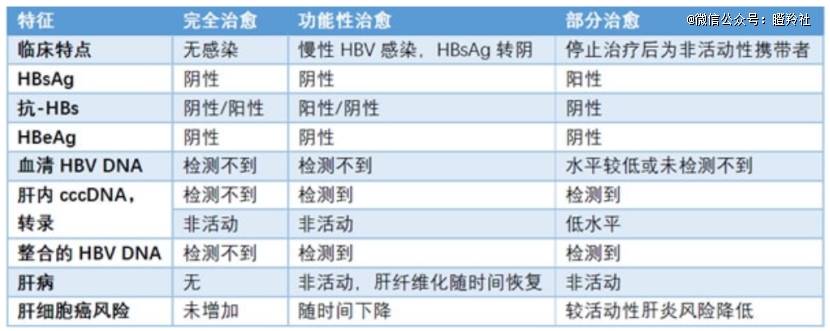
功能性治愈和完全彻底治愈区别在于,功能性治愈未能清除肝内共价闭合环状的DNA和整合基因组的HBV DNA,功能性治愈是经过一段时间的治疗后患者的免疫系统足以压制乙肝病毒,也能安全停药,肝损伤恢复,肝癌风险降到*。
而功能性治愈,不同于彻底治愈的完全清除掉乙肝病毒,由于乙肝病毒仍然存在,随着患者免疫力下降,仍有复发的可能,所以实现乙肝功能性治愈的药物不存在像吉利德推出的丙肝*药Sovaldi把大部分病人都彻底治愈且治疗市场萎缩的情况,另一方面现有的技术也无法短时间实现乙肝的彻底治愈。
目前国内一线抗乙肝病毒治疗药物有两大类,分别为干扰素和核苷(酸)类似物,这两类药物优缺点都比较明显:
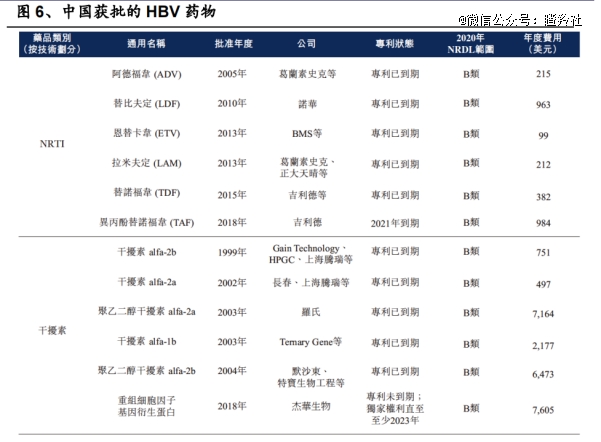
干扰素是较强的免疫调节剂,既具有抗病毒作用,又具有抗纤维化作用,其优点在于疗程相对固定、疗效相对持久、耐药变异较少;缺点是需要注射给药,不良反应较明显,不适于肝功能失代偿者。
高效的一线核苷药物够将病毒载量抑制到无法检测的水平。然而一旦治疗停止,绝大多数患者会出现病毒反弹,因此需要接受终身治疗。
最核心的痛点是,这两类药物均无法在短期内清除乙肝病毒,并且治愈率较低(3%-7%),多数患者需终身服药抑制HBV的复制,防止病毒对肝脏造成损害。
市场急需一款能够实现HBV功能性治愈的新型药物,患者余生中可免于服用HBV药物,并显著降低罹患肝硬化及肝癌风险,这无论是社会价值还是经济价值,都十分巨大。
02 广生堂的GST-HG141
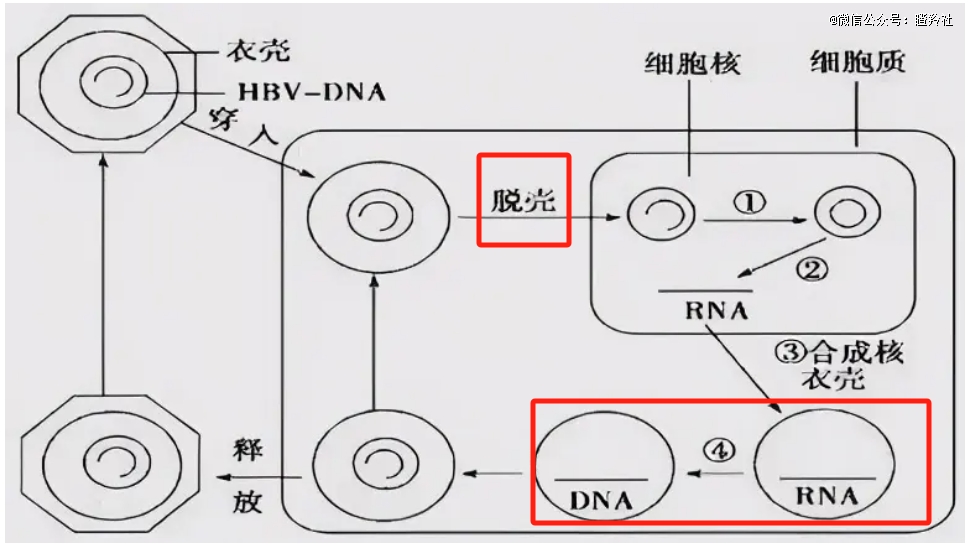
乙肝之所以难治,核心在于HBV病毒会通过肝细胞膜上NTCP作为受体进入并感染肝细胞,在其中建立其基因组,即具有染色体特征的共价闭合环状DNA(cccDNA),同时HBV病毒还可能将编码表面抗原的部分基因片段至宿主肝细胞基因组中,这两个部分很难被靶向和清除。
现有药物多针对HBV病毒生命周期的其中一环,比如控制病毒复制,但大多不足以根除cccDNA。
不同于现有的干扰素、核苷酸药物,广生堂的GST-HG141是一种乙肝核心蛋白(HBcAg)抑制剂(也可称I类MOA核衣壳抑制剂)。
这里就不得不提乙肝病毒的特点,HBV是一种有包膜的病毒,包膜由乙肝病毒核衣壳的3种病毒表面蛋白LHBs、MHBs和SHBs组成;而核衣壳则是由HBV核心蛋白控制形成,HBV核心蛋白是一种对HBV生命周期至关重要的多功能蛋白,如果核衣壳的组装和功能受到干扰,可能影响HBV DNA的复制,严重削弱子代病毒的毒性和再次侵染能力,因此具有抗病毒作用。
显而易见,GST-HG141是一种病毒核衣壳组装抑制剂(CpAM)。这类CpAM又细分为两类抑制剂,一类是诱导异常核心结构的形成的II类MOA,另一类是诱导形成形态完整但病毒核酸缺失的衣壳的I类MOA。
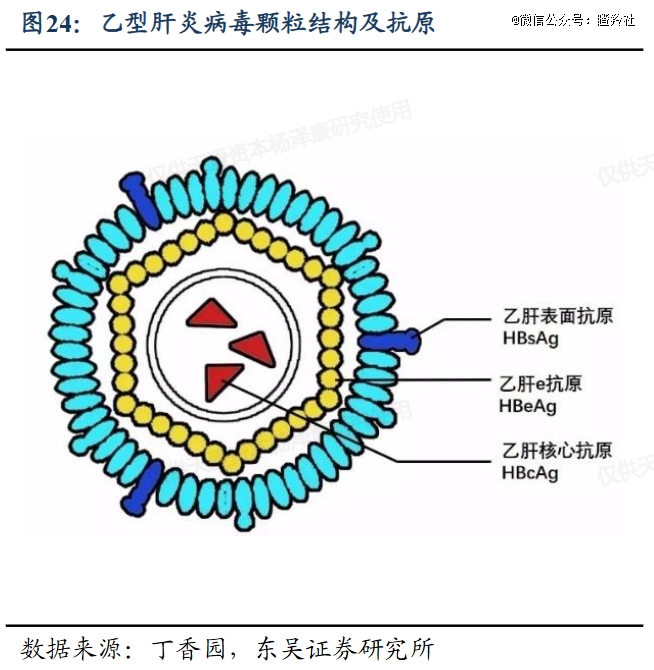
GST-HG141是典型的I类MOA核衣壳抑制剂,从发挥作用机理便能看出:
1)当HBV在肝细胞核孔进行脱壳时,该分子可以附着在HBV表面来稳定病毒衣壳结构抑制HBV脱壳,阻止HBV DNA进入肝细胞核产生出cccDNA并削减cccDNA储备池,阻止cccDNA转录出多种mRNA并续贯复制出三种主要抗原;
2)该分子具备强于核酸的亲合力,在子代HBV组装时诱导病毒衣壳蛋白不依赖于子代HBV-DNA发生自发组装,大量形成不包含子代HBV-DNA的空泡病毒,从而隔绝子代病毒复制能力。
从已有的疗效数据看,GST-HG141的疗效和安全性遵循其作为I类MOA核衣壳抑制剂的作用机理:
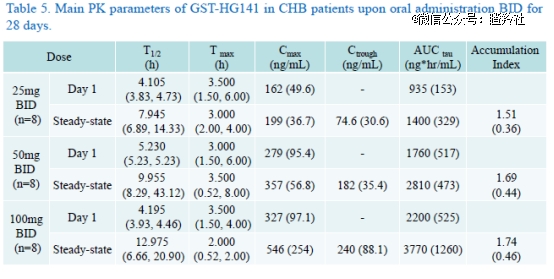
EASL 2022公布的GST-HG141多递增剂量治疗慢性乙肝的1b期临床研究数据显示:25、50和100mg队列均(BID给药)观察到了血清HBV DNA迅速而强劲地下降,血清pgRNA也有显著下降,未观察到病毒学突破;PK方面,血浆GST-HG141暴露几乎与剂量成正比增加。
安全性方面,三个队列的患者耐受性良好,未见剂量相关性不良反应,未发生3级以上不良反应,未发生SAE。
据广生堂公告的GST-HG141最新公布的慢性乙型肝炎低病毒血症二期临床数据(90 例患者)显示:不同剂量GST-HG141均表现出明显的HBV DNA抑制效果,GST-HG141联合核苷类似物连续治疗24周,高低剂量组HBV DNA低于检测下限的比例达到81.5%和84.0%(意味着药物疗效显著,控制乙肝病毒在正常范围内),远超核苷类似物单药治疗(32.1%),而且疗效稳定无波动。
更值得注意的是,患者HBV DNA和pgRNA下降幅度均超过1 log10,进一步验证了GST-HG141阻断HBV病毒复制和耗竭cccDNA的作用。
从单个管线到全局,广生堂在治愈乙肝的路上做出了很多努力,除了GST-HG141之外,公司还布局了一、二代HBsAg抑制剂GST-HG131和GST-HG121,其中GST-HG131的临床进度推进与GST-HG141保持一定同步,旨在实施先使用GST-HG141对乙肝患者cccDNA进行耗竭,再序贯使用GST-HG131实现HBsAg血清学清除或血清学转换(其中还可能出现两者联用进行过渡),最终达到以停药为目的的临床治愈目标。
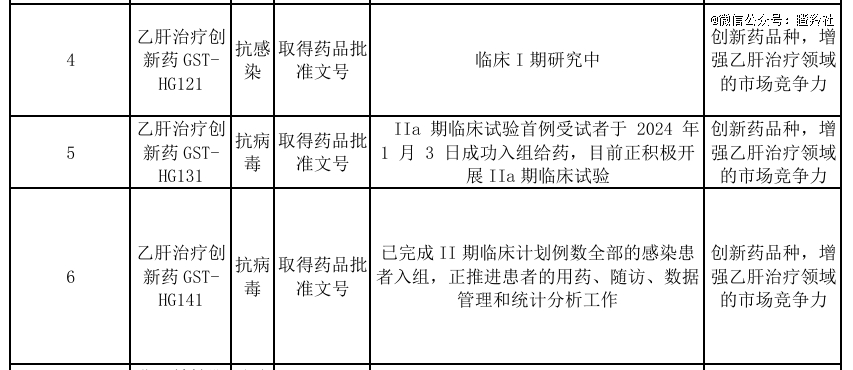
(来源:2023年广生堂年报)
03 海外价值对标
对于GST-HG141的临床进度而言,广生堂将其称之为全球潜在FIC口服乙肝抗病毒药物其实“有理有据”。
早在GST-HG141进入临床之初,全球同属I类MOA核衣壳抑制剂的还有Assembly Bioscience的ABI-H0731、ABI-H2158及ABI-H3733。
早在2020年,百济神州曾经以“4000万美元首付+最高不超过5亿美元+分成”获得Assembly Bioscience上述三款分子的中国权益(含港澳台地区)。如今三个分子均因不同原因被终止开发,如Vebicorvir (ABI-H0731)是在与核苷酸、干扰素的三联用药三期临床中的数据不支持对慢性乙肝患者实现有意义的功能性治愈而被放弃,ABI-H2158是由于二期临床中患者出现严重肝毒性而被迫终止开发。
上述两个项目终止后,ABI-H3733和ABI-4334这个新一代病毒核衣壳组装抑制剂被Assembly给予厚望,临床前数据显示两者抑制新cccDNA形成方面的效力比ABI-H0731分别高35倍和900倍。后ABI-H3733也因为优先级被Assembly公司终止,转而专注在ABI-4334的临床推进上。
ABI-4334在2023年公布的最新一期数据也比较优良,每天给药一次,单次口服最高剂量达400mg,患者具有良好耐受性(避免了之前公司老一代管线的毒性,临床中没有出现三级TARE和相关SAE),仅中间剂量便能实现高效的HBV DNA抑制和cccDNA生成抑制。
尽管如此,在经历了诸多波折后,Assembly Bioscience调低了乙肝管线的优先级,且市值也跌落谷底,公司市值仅为8294万美元。
除了病毒核衣壳组装抑制剂,全球也出现了一些致力于治愈乙肝的新型药物,其中比较火热的是小核酸药物,包括反义寡核苷酸(ASO)和小干扰RNA(siRNA),前者如GSK的3228836和Aligos的ALG-020572,后者如VIR-2218。
GSK的3228836的二期慢性乙肝临床结果显示:使用每周300mg治疗24周可使26%的核苷类似物经治和29%的乙肝初治患者获得乙肝表面抗原清除、HBV DNA阴转,随访24周后上述比例分别降至9%和10%,保持效果差且复发率高(同时肝毒性也值得注意),需要续贯长效干扰素治疗。
VIR-2218呈现出与GSK的3228836类似的表现,其二期临床结果显示:在接受VIR-2218与长效干扰素组合疗法的31名受试者中,8名患者(25.8%)在治疗结束时出现乙肝表面抗原清除,5名患者(16%)在治疗结束后的24周实现了持续的乙肝表面抗原水平清除。值得注意的是,非头对头数据对比如VIR-2218单药治疗,那么患者HBV DNA复阳概率则比GSK3228836更高。
结语:广生堂的回落,与公司未公布完整数据有关,无论是病毒核衣壳组装抑制剂还是小核酸药物在24周治疗结束全球均已有管线表现出不错的疗效,但更重要的是随后24周随访中患者的乙肝表面抗原水平和HBV DNA转阳率,这代表了药物的持久程度和中期疗效,让我们期待GST-HG141的完整数据。
【本文由投资界合作伙伴微信公众号:瞪羚社授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






