中国人的尿酸水平在快速升高。
一项纳入了200多万人的研究显示,从2001年到2017年,中国大陆15岁以上人群高尿酸血症(HUA)的患病率从8.5%攀升到了18.4%,翻了一倍多,华南更是“重灾区”。
很长一段时间内,人们只知道长期尿酸高,痛风和肾结石的风险会增加。但随着医学研究的不断深入,尿酸升高与其他慢性病的关联开始浮现。
这是一个重要的公共卫生问题。中国人的尿酸为什么越来越高了?又是什么造成了地区差异?我们试图揭开这个问题的一角。
中国高尿酸地图
大多数高尿酸血症患者没有症状,得知自己尿酸升高,常源于一张体检单。在人们模糊的印象中,近些年来查出尿酸升高的人越来越多。
这并不是错觉。2021年发布的一项研究中,研究者分析了177项研究、200多万人的数据,发现2001年时,中国大陆15岁以上人群高尿酸血症的患病率还在8.5%,到了2017年,数值攀升到了18.4%,不到二十年翻了一倍多。
2022年发布的另一项全国性调查也得出了惊人的结果。利用中国营养与健康监测数据、纳入了52627名受试者,该调查发现我国18~59岁成年人高尿酸血症预计的总体患病率为15.1%,意味着每20个成年人中,有接近3人尿酸异常。
这是总体的趋势。如果更为细致地分析,则会发现尿酸升高的情况在不同地区存在着差异。
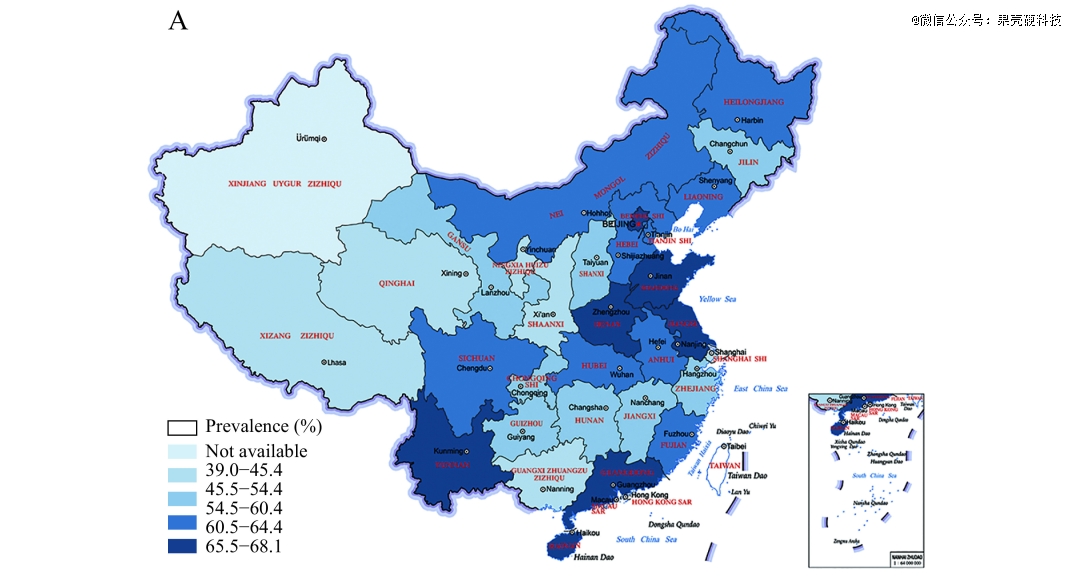
中国是世界上*的发展中国家,14亿人分布在广袤的土地上。在上述涉及200多万的人研究中,研究者进一步将中国大陆划分为了7个地区,东部、北部、中部、南部、西南、西北和东北(见下图)。其中以两广为代表的华南地区,和以云贵川藏为代表的西南地区,高尿酸血症的患病率领跑全国,分别为25.5%和21.2%。
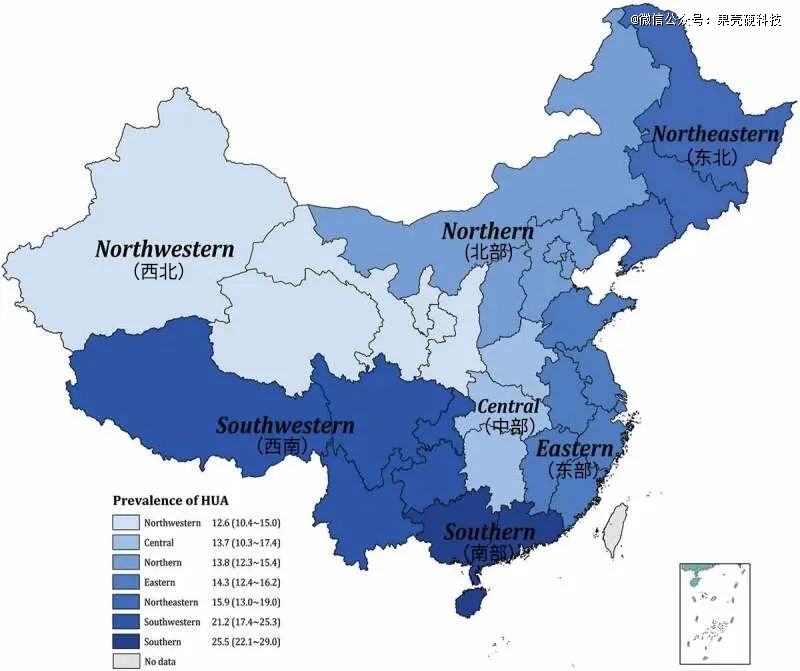
华南地区和西南地区,15岁以上人群高尿酸血症的患病率领跑全国丨原图:参考资料1
极高值出现在广东省,15岁以上人群患病率达到42.2%。在另一项针对广东省东莞市清溪地区2940名健康体检人群的调查中,男性血尿酸异常检出率更是高达51.89%,研究者直称“尿酸升高威胁着清溪地区人群健康”。
数据揭示着中国人高尿酸的现实。根据《中国高尿酸血症相关疾病诊疗多学科专家共识(2023)》,在中国,高尿酸血症已成为仅次于糖尿病的第二大代谢性疾病。
当平衡被打破
人体内的尿酸,主要始于一种叫做“嘌呤”的有机物。
嘌呤有两种来源。一种是“系统自带”的,自人出生起就存在于体内,是遗传物质DNA和RNA的重要组成成分。一种是外来的,当人们摄入含有嘌呤的食物时,它们随之进入体内。
在健康人体内,肝脏会把多余的嘌呤处理掉,此过程中便会产生尿酸。作为代谢废物的尿酸可溶于血液,约有2/3通过肾脏排出,其余1/3则通过消化道。
正常情况下,人体内尿酸的产生和排泄维持着动态平衡。但很多因素能打破这个平衡,使得尿酸生成过多或者排泄减少,从而升高人体内的尿酸值。
正常嘌呤饮食情况下,成人在不同两天测得的空腹血尿酸水平均超过420μmol/L(7mg/dL),即可被诊断为高尿酸血症。
生理因素中,年龄和性别对于尿酸水平的影响是明确的。
随着年龄的增加,肾脏的结构和功能会发生变化,过滤能力也会生理性减弱。大约从30~40岁开始,肾小球滤过率每年大约减少1ml/min/m2。这种自然变化,会升高人体的尿酸值。
男性通常比女性更容易尿酸高。从青春期开始,男性的尿酸开始普遍高于女性;在50岁以前,男性高尿酸血症的患病率约是女性的2~4倍,50岁之后,两性间的差距开始缩小。
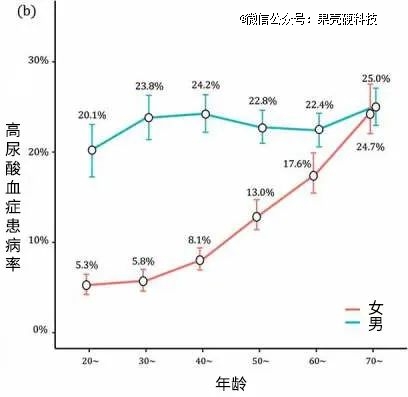
成年男性通常比女性更容易尿酸高(蓝线为男性,红线为女性)丨原图:参考资料1
雌激素被认为是造成性别差异的主要原因。雌激素能影响肾脏的清除和重吸收等功能,其高低与尿酸水平呈现负相关。由于第二性征的发育、激素的不同,尿酸水平在青春期开始出现性别差异。这也是为何,成年男性尿酸普遍高于同龄女性,但绝经后女性人群与男性的差距逐渐缩小。
社会在变化,我国人口预期寿命增加、老龄化加剧,加上健康体检的普及度变高,比如覆盖率更高的职工体检、特殊人群福利性检查等,被检出尿酸升高的人群比例自然也会随之增加。
但这还不足以成为中国人尿酸水平迅速增高的原因,更解释不了地区差异,这背后还有更多的因素在“发力“。
遗传和生活方式的“双重打击”
家族和双胞胎研究是两种常用的遗传学研究方法。前者观察具有血缘关系的家庭成员,后者比较同卵或异卵双胞胎,以发现疾病或症状与遗传的关系。通过这两种方法,研究者们发现,人群中血尿酸水平的差异,有25%~60%是遗传因素决定的。
全基因组关联分析(GWAS)是一种研究大量个体的基因组,以找出与特定疾病或性状相关的遗传变异的方法。利用该方法,目前已发现多个与高尿酸血症和痛风相关的基因,有研究者甚至在中国汉族人群中,发现了特有的易感基因RFX3和KCNQ1,它们可能直接或间接引起高尿酸血症和痛风。
可见从遗传学角度来看,中国人并没有特定的基因优势来“免疫”高尿酸血症和痛风。
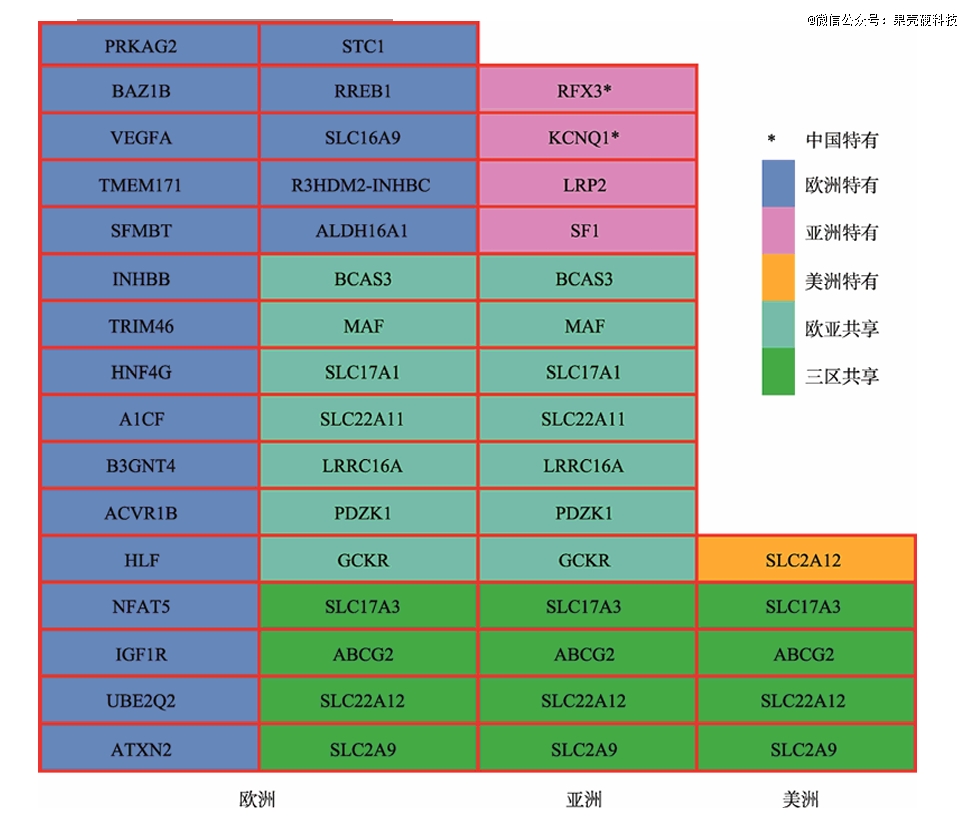
不同人群易感位点的比较,其中RFX3和KCNQ1(该基因同时也是糖尿病易感基因)为中国特有丨参考资料7
尿酸升高是一个全球性的健康问题。上世纪七八十年代开始,美国、日本等发达国家就经历了尿酸水平普遍上升的情况,人群高尿酸血症患病率一度超过20%。但得益于较早发现并重视这一现象,近年来这些国家高尿酸血症的患病率已经开始趋于稳定。
相比之下,中国人群的患病情况呈现出独有的特点。首先,患病率开始上升的时间较晚,但增长迅猛;其次,年轻化趋势明显,在一项针对54580名儿童青少年的汇总研究中,我国3~19岁儿童青少年高尿酸血症的患病率从2009~2015年间的16.7%上升到了2016~2019年间的24.8%,甚至高于美国、韩国儿童青少年的同期患病率。
如此迅速的发展,跟生活方式的变化脱不开关系。除了遗传因素,目前医学界普遍认可,生活方式会影响尿酸水平,比如饮食习惯。
一些食物是天然的“升尿酸”大户,它们要么本身富含嘌呤,要么能通过其他途径让身体产生更多尿酸。代表性食物包括海鲜中的某些鱼类和贝类(凤尾鱼、沙丁鱼、鳕鱼、龙虾、贻贝、扇贝等),常见的一些肉类(牛肉、羊肉、内脏等),酒精饮料(尤其是啤酒),以及果糖。
随着生活水平的改善、物流的发达,我们吃下的这些食物正在增多。
近十年间,我国动物性水产品消费上涨明显,人均食用水产品消费量增长了33%。成年人饮酒流行率也从2007年的35.7%增加到了2015年的41.3%。还有研究发现,与2002年相比,2018年中国居民红肉平均摄入量增加了134.3%,含糖饮料(工业果糖的主要应用领域之一)增加了16.1%,两者的平均摄入量均高于膳食指南的推荐水平。
吃得更多,风险也会上升。来自北京协和医院的研究者们系统分析了19项研究,发现高尿酸血症与红肉、海鲜、酒精、果糖的摄入呈正相关。具体来说,食用红肉、海鲜、酒精和果糖分别增加了研究受试者24%、47%、106%、86%的高尿酸血症风险。
有升高风险的生活习惯,自然也有降低风险的习惯,但现实情况是,后者我们做得也不太好。
合理的饮水可促进尿酸排泄。轻体力活动者建议每天饮水1500~1700毫升,高尿酸血症与痛风的人心肾功能正常时,每天饮水2000~3000毫升。但饮水不足的情况很常见,比如有研究抽样调查了北京、成都、上海、广州四个城市成年居民的夏季饮水量,发现1/3的人每日饮水量不足1200毫升。
规律、适量的运动也有利于尿酸的代谢。无论是预防还是改善高尿酸血症,目前国内外指南都鼓励运动作为非药物疗法的重要组成部分,如每周至少进行150分钟中等强度的有氧运动,这个运动量也是世界卫生组织认为的“体力活动充足的*标准”。
但有研究显示,从2010年到2018年,中国成年人体力活动不足的比例从17.9%上升到了22.3%,18~34岁年龄组增加最为显著。可以说,目前至少有超过五分之一的中国成年人,体力活动水平没有达到上述的*标准。相比之下,根据《柳叶刀-全球健康》发布的一项大型研究,在澳大利亚、英国、美国等28个西方高收入国家,2000~2022年成人体力活动不足的情况,呈下降趋势。
当增加风险的事情干得更多了,减少风险的事干得更少了,整个群体尿酸升高的现象,或许就难以避免了。
地区差异:有的省份咋高成这样?
在一个家庭里面,饮食习惯会有相似性;在一个特定地区,饮食习惯也会趋同,形成独特的地区饮食模式。因此在进一步探索中国高尿酸血症地区差异的原因时,研究者们也将其与各地饮食文化联系了起来。
一种颇为概括的对应关系是,如果一个地区海鲜摄入丰富、酒文化盛行、红肉内脏食材多见、高果糖食品流行,那该地方可能面临着更高的尿酸危机。
以海鲜为例。中国水产品消费市场里,广东省的消费量一骑绝尘。根据推算,我国居民水产品食用消费总量最多的3个省为广东、浙江、江苏。2022年,全国动物性水产品食用消费总量鲜重约4837万吨,广东省吃掉了761.20万吨,占比15.7%;人均60.15千克,超过了平衡膳食宝塔推荐的摄入量上限(50.23千克/年)。
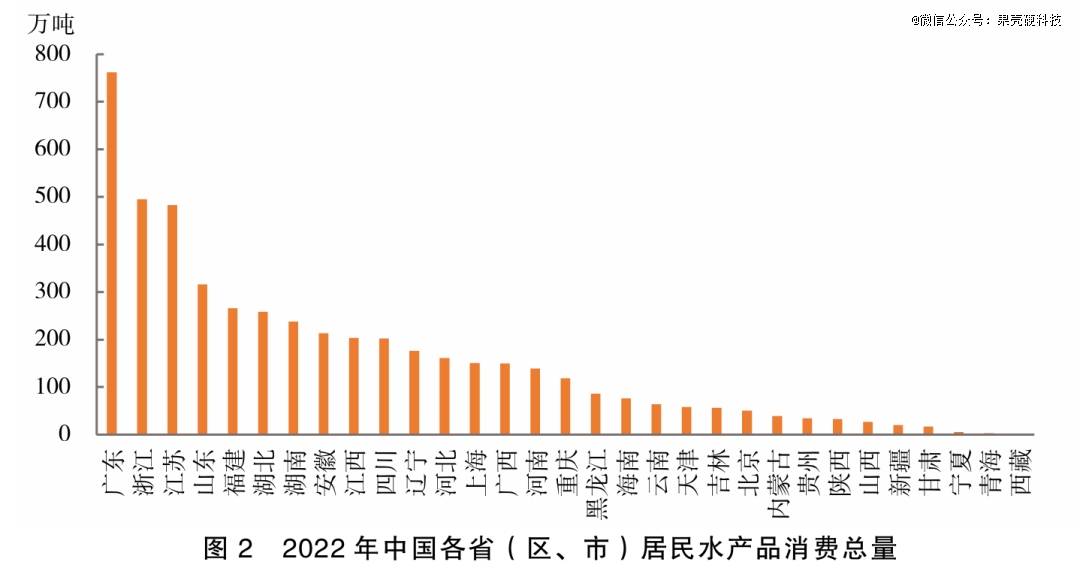
中国水产品消费市场里,广东省一骑绝尘丨参考资料13
中国疾病预防控制中心发布过一项研究,通过对31个省级行政区189198名成年人进行的代表性调查,发现中国南部地区的饮酒率也是最高的,在过去12个月内,男性饮酒流行率为69.1%,女性为28.4%。
2015年中国各省男性过去12个月的年龄标化饮酒流行率丨参考资料14
当然,疾病和症状的地区差异是个非常复杂的问题,独特的饮食习惯或许能解释一部分原因,但无法描述全貌。
实际上,人们对某些食物的偏好,一定程度上也受遗传因素的影响。科学家们已经发现了一些特定的基因变异,会影响我们是否喜欢某些食物,例如喝酒的习惯,遗传因素的影响可能在43%到53%之间。可见,一个地区饮食模式的形成不仅仅是靠山吃山、靠水吃水,更是遗传、环境交织在一起构成的复杂画面。
地区高发的特定疾病也可能和高尿酸血症相关。有研究分析了900多万人的数据,发现中国南部以及西南地区慢性肾病(CKD)高发,广西、四川两个省份最为严重,其次是贵州。研究者猜测,遗传差异加上饮食习惯是这些地方慢性肾病高发的原因,比如西南地区高钠的熏制肉类消费量大,可能增加肾病的风险。
慢性肾病和高尿酸血症密切关联。一方面,高尿酸血症是慢性肾病的危险因素;另一方面,得了慢性肾脏病,肾脏功能受损也会影响尿酸的代谢。广西、四川、贵州等地不低的高尿酸血症患病率,或许也跟特殊的疾病谱有关系。
果糖的甜蜜陷阱
在众多能升高尿酸的食物中,果糖值得单独提起。它本身不含嘌呤,容易被忽视。并且果糖的流行,背后离不开工业化、商业化的共同推动。
果糖原本主要存在于水果和蜂蜜中,然而我们吃下的大部分果糖并不是这种天然来源的。1957年,美国生物化学家理查德·马歇尔(Richard Marshall)和同伴发现了一种酶,可以将玉米糖浆中的葡萄糖通过结构重排转化为果糖;大概十年后,日本工业技术研究院的高崎义幸(Yoshiyuki Takasaki)团队,实现了这种酶的量产。
从此,甜度高、生产成本低、高度浓缩的工业果糖制品登上历史舞台,也成了人们摄入果糖的主要途径。
果葡糖浆便是以果糖为主要成分的糖浆制品。在含糖饮料、甜品、酱料等超加工食品中,这种成分随处可见。糖业公司嘉利高(Czapp)2019年时做过一项分析,同样是甜味剂,果葡糖浆与食糖(白糖、冰糖等)相比价格优势明显,分析人员认为这会刺激工业上继续加大果葡糖浆的使用量,饮料领域可能发生更多果葡糖浆替代食糖的现象。
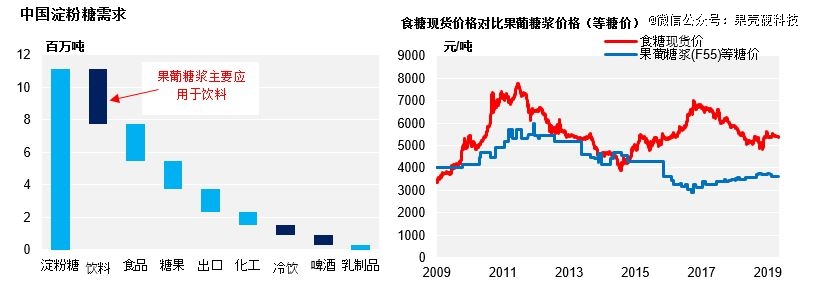
2019年时,食糖和果葡糖浆(等糖价)的价差维持在1724元/吨的水平丨czapp.com
根据智研咨询发布的行业报告,无论是市场规模、产量还是需求量,果糖在中国市场也都呈上升趋势,如需求量从2016年的300.3万吨增长至2023年的约383.93万吨。但在差不多同一时期,全球其他国家或地区高果糖甜味剂的生产处于停滞或下降局面。
美食环绕、市场向好,但在升高尿酸方面,果糖是一个“甜蜜的陷阱”。
食糖的主要成分是蔗糖,由一个果糖分子和一个葡萄糖分子组成。果糖和葡萄糖是最常见的两种单糖,除了一些化学键不同外,两者在结构上几乎一样。但微小的差异却让它们的甜度、在人体内的代谢途径截然不同。
我们通常使用“相对甜度”这一指标来衡量甜味物质的甜度,其中蔗糖被设定为基准,甜度值为100。与蔗糖相比,葡萄糖的相对甜度为70~80,果糖的相对甜度则高达150~170,在较少的用量下便可达到与蔗糖、葡萄糖同样的甜度。与此同时,果糖的甜度优势在低温环境下会更显著,比如在0~10℃的环境中,果糖溶液的甜度可以是相同浓度葡萄糖溶液的两倍以上。
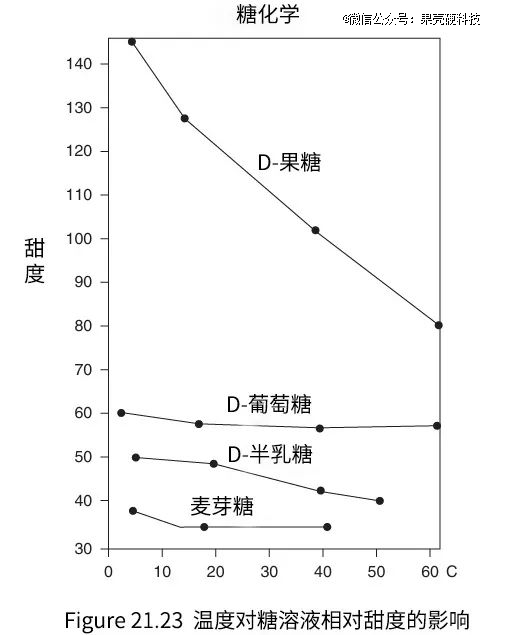
果糖的甜度优势在低温环境下会更显著,因此更受需冷藏、可冷藏超加工食品的“青睐”丨原图:参考资料22
葡萄糖被吸收进入血液后,主要用于供能,多余的会以糖原的形式储存在肌肉、肝脏中,或进入脂肪细胞以备不时之需。果糖进入人体后,则会被运送到肝脏进行代谢。在肝脏中,分解果糖的酶开始工作,一系列复杂过程中会有一种叫做单磷酸腺苷(AMP)的物质形成,而它正是尿酸生成的底物。
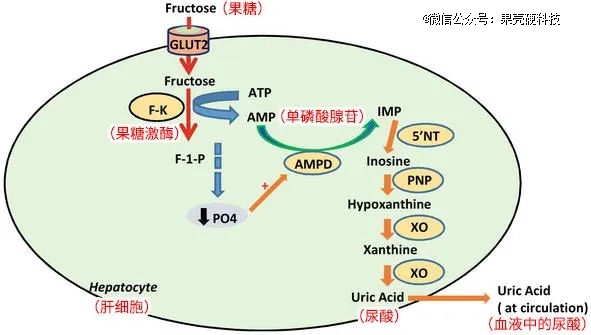
果糖在肝脏的代谢丨原图:intechopen.com
因此摄入的果糖越多,促进合成的尿酸也越多。而加了大量果糖的超加工食品,通常饱腹感差,享乐效益也明显,这会导致即使生理上我们不需要能量,还是容易忍不住大快朵颐,甚至越吃越想吃,尿酸升高的风险也加大。
饮食中的糖摄入量与一系列代谢性疾病有关,比如异位脂肪堆积、肥胖、心血管疾病等,研究者们认为这很大程度上可归因于过量摄入果糖,并且尿酸合成过多可能是重要的中间机制之一。这也让尿酸和更多慢性疾病的关联开始浮现。
尿酸与疾病的关联,远不止痛风
前面提到,临床上高尿酸血症的诊断界值是420μmol/L(7mg/dL)。这是个颇为“暧昧”的数值。人体血液中尿酸的饱和浓度就约为420μmol/L,当超过这个数值,原本溶于血液的尿酸便会以单钠尿酸盐晶体的形式析出。
当这些晶体持续不断地产生、越积越多,便可以沉积在关节以及周围软组织,这便是痛风的生理基础。
早在18世纪末,医学界就已经发现尿酸和痛风的关联。作为现代社会最常见的疾病之一,痛风会造成患者一个或多个关节突发的重度疼痛、肿胀、发红。它所带来的痛苦,被描述为“疼到连床单的重量都难以忍受”。
在传统认识中,尿酸升高的风险直指痛风以及肾结石(晶体沉积在肾脏导致)。医学术语中的“无症状高尿酸血症”,指的也是没有痛风和肾结石相关的表现。但随着医学研究的不断深入,这个传统认知被打破,越来越多的研究开始揭示高尿酸与其他慢性病的关联,比如高血压、糖尿病、肥胖、代谢综合征等。
一项纳入了18项前瞻性队列研究、55667名受试者的荟萃分析发现,高尿酸血症和高血压的风险增加相关,尿酸水平每升高1mg/dL,高血压发病风险增加13%。而高血压又是一系列心血管疾病的风险因素,比如卒中、冠心病。
还有研究者追踪了9471人,平均随访时间2.9年,发现尿酸较高的人,后期患2型糖尿病的风险也相对较高,尿酸水平每升高1mg/dL,调整其他变量后2型糖尿病风险增加9%。该研究甚至还发现,如果一个人的血尿酸水平在一年内增加了30%以上,那么患糖尿病的风险会增加30%;相反,如果尿酸水平下降了10%以上,那么糖尿病的风险会减少21%。
多项研究显示,肥胖和高尿酸之间也关系密切,可能存在双向关联。肥胖患者的代谢特征、饮食习惯等,可能导致体内尿酸增高;而高尿酸血症也可以通过一系列机制,对血脂代谢产生影响,增加肥胖风险。
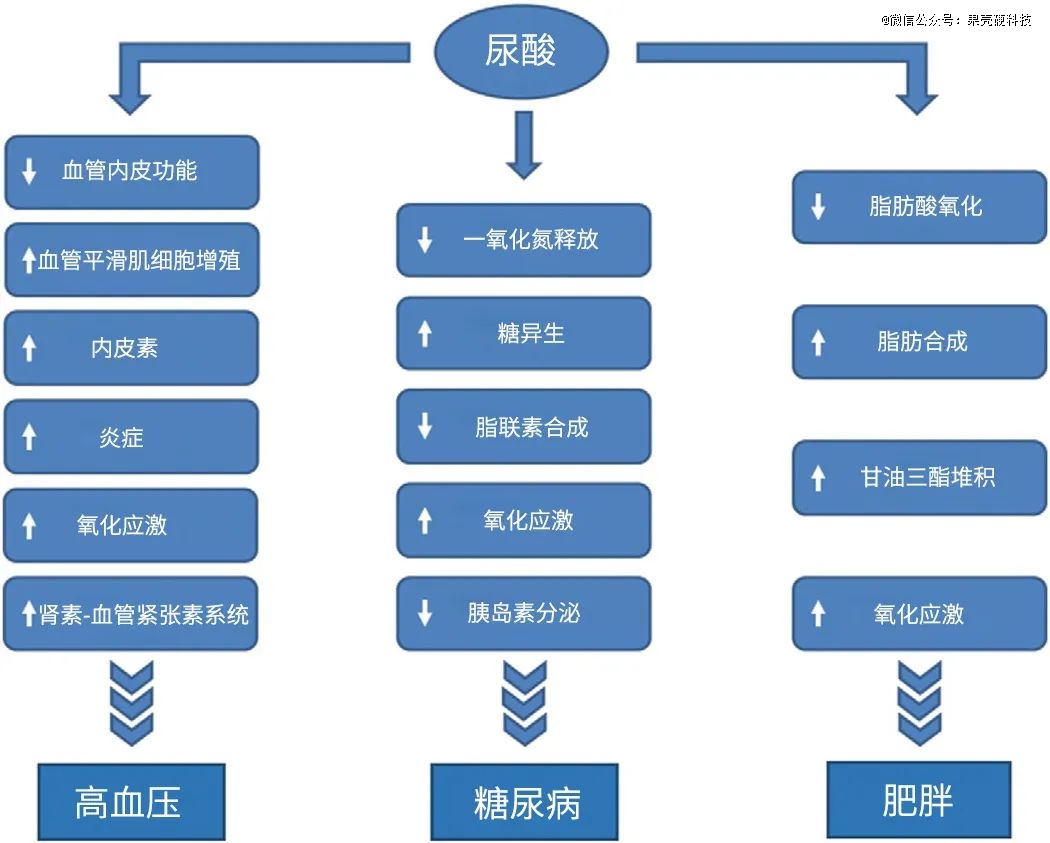
尿酸与慢性病之间可能涉及的一系列机制丨原图:参考资料27
更有研究者分析了中国台湾人体生物资料库(Taiwan Biobank)1万名参与者的数据,发现尿酸可能通过增加血压、增加甘油三酯(脂肪的组成成分)水平、降低高密度脂蛋白胆固醇(HDL-C)值,来增加代谢综合征的风险。
除此之外,不同医学研究中还陆续发现了高尿酸血症与非酒精性脂肪性肝病、慢性炎症甚至阿尔茨海默病等的潜在联系,虽然充分阐释因果关系和机制还需要更多时间和研究,但一个基本共识是尿酸这个指标应该得到更多的关注。
祖先的印记,现代的生活
在很多哺乳动物体内,有一种叫做“尿酸氧化酶”的物质,它可以分解尿酸,将其转变为水溶性更强的尿囊素,因此更容易被肾脏排出体外。但在人类和一些高等灵长类动物中,这种酶是缺失的。
研究生物演化学的学者们猜测,尿酸氧化酶相关基因的缺乏对人类祖先的生存可能有益。远古环境恶劣,人类祖先中那些能够长时间忍受能量短缺的个体,更有生存机会。而该酶的缺乏可以增加尿酸,然后通过增加血压、脂肪存储等方式,增加生存优势。整个“优胜劣汰”的演化过程是漫长的,历经数百万年。
而人类生存环境的转变来得太快。短短几十年、上百年时间,食品工业飞速发展,物质极大丰富,现代居民的生活方式发生了巨大变化。但环境变化的速度,和人类自然演化的速度并不匹配,生活在当下的人们还没有演化出解决大量尿酸的能力。
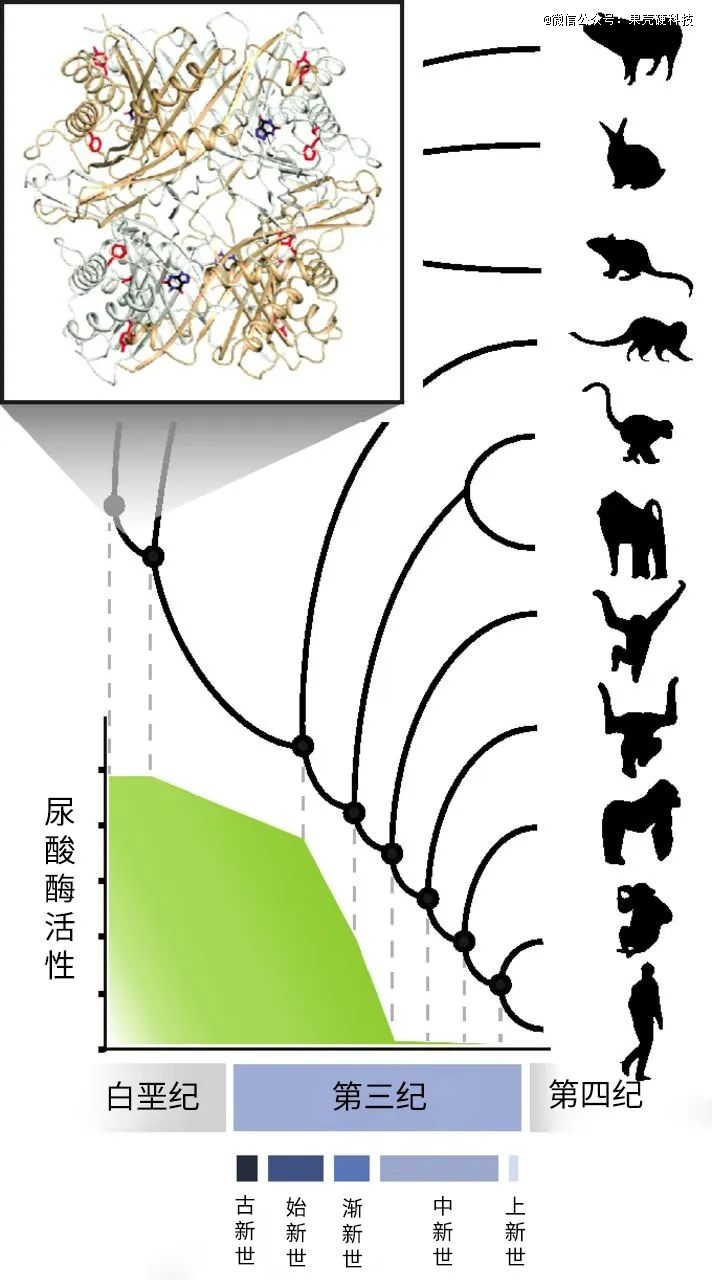
研究者还原的尿酸氧化酶的演化过程丨原图:参考文献29
根据中国专家共识,在高尿酸血症患者管理方面,应给予饮食、运动等方面的健康指导,制定个性化的生活方式干预,效果不佳时启动药物治疗。尤其是年轻的高尿酸患者,要降低后续风险,从此刻开始改变生活方式是*的,比如饮食上多食用全谷物、新鲜蔬菜等,每周至少进行150分钟中等强度的有氧运动,并戒烟限酒等。
但现实情况下,这并不容易。人们摄取食物有两大主要动机:对抗饥饿和追求愉悦。在当前这个充满不确定性和压力的时代里,食物带来的愉悦感似乎在发挥更大的作用,甚至成为了很多人寻求慰藉的方式。而容易引起尿酸升高的食物,很多正是所谓的“快乐源泉”。
持续的合理饮食、规范运动、及时寻求并响应医疗建议,也需要投入金钱、时间、精力,或者需要适宜的场所。但很多人可能因工作繁忙、生活节奏快、居住环境限制或经济能力不足等,不具备这些条件。
更何况,即使个人可以通过改变生活方式让身体指标更健康,但群体性的健康问题早已超越了个人层面,更是社会问题。尿酸水平的普遍升高,甚至血糖、血压、体重等更受关注的健康指标的群体性变化,不仅是个人行为的反映,更是时代特征的缩影,要解决它们自然也需要社会更多的努力和支持。
但所有人都知道,这是一个漫长也艰难的过程。
参考资料:
1.Li Y, Shen Z, Zhu B, Zhang H, Zhang X, Ding X. Demographic, regional and temporal trends of hyperuricemia epidemics in mainland China from 2000 to 2019: a systematic review and meta-analysis. Glob Health Action. 2021 Jan 1;14(1):1874652. doi: 10.1080/16549716.2021.1874652. PMID: 33475474; PMCID: PMC7833047.
2.Piao W, Zhao L, Yang Y, Fang H, Ju L, Cai S, Yu D. The Prevalence of Hyperuricemia and Its Correlates among Adults in China: Results from CNHS 2015-2017. Nutrients. 2022 Oct 2;14(19):4095. doi: 10.3390/nu14194095. PMID: 36235748; PMCID: PMC9573360.
3.李小伟,闻向晖,黄眷杰,等. 广东清溪地区健康体检人群血糖、血脂和血尿酸结果分析 [J]. 广州医科大学学报, 2023, 51 (06): 33-37.
4.方宁远,吕力为,吕晓希,等. 中国高尿酸血症相关疾病诊疗多学科专家共识(2023年版) [J]. 中国实用内科杂志, 2023, 43 (06): 461-480. DOI:10.19538/j.nk2023060106.
5.戴维·珀尔马特.疯狂的尿酸:不止是痛风[M].北京:北京科学技术出版社,2023
6.George C, Leslie SW, Minter DA. Hyperuricemia. [Updated 2023 Oct 14]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK459218/
7.郑敏,麻骏武. 高尿酸血症和痛风的遗传学研究进展 [J]. 遗传, 2016, 38 (04): 300-313. DOI:10.16288/j.yczz.15-385.
8.Li, C., Li, Z., Liu, S. et al. Genome-wide association analysis identifies three new risk loci for gout arthritis in Han Chinese. Nat Commun 6, 7041 (2015). https://doi.org/10.1038/ncomms8041
9.Rao J, Ye P, Lu J,et al. China Child and Adolescent Hyperuricemia Study (CCAHS) Consortium. Prevalence and related factors of hyperuricaemia in Chinese children and adolescents: a pooled analysis of 11 population-based studies. Ann Med. 2022 Dec;54(1):1608-1615. doi: 10.1080/07853890.2022.2083670. PMID: 35695553; PMCID: PMC9225777.
10.Major T J, Topless R K, Dalbeth N, Merriman T R. Evaluation of the diet wide contribution to serum urate levels: meta-analysis of population based cohorts BMJ 2018; 363 :k3951 doi:10.1136/bmj.k3951
11.Li R, Yu K, Li C. Dietary factors and risk of gout and hyperuricemia: a meta-analysis and systematic review. Asia Pac J Clin Nutr. 2018;27(6):1344-1356. doi: 10.6133/apjcn.201811_27(6).0022. PMID: 30485934.
12.Fang Y, Xia J, Lian Y, Zhang M, Kang Y, Zhao Z, Wang L, Yin P, Wang Z, Ye C, Zhou M, He Y. The burden of cardiovascular disease attributable to dietary risk factors in the provinces of China, 2002-2018: a nationwide population-based study. Lancet Reg Health West Pac. 2023 May 8;37:100784. doi: 10.1016/j.lanwpc.2023.100784. PMID: 37693878; PMCID: PMC10485670.
13.李雪,高翔,赵蕾,等. 中国居民水产品食用消费量测算与分析 [J]. 中国渔业经济, 2024, 42 (02): 95-104.
14.Zhao Z, Wang L, Zhang M, Zhang X, Huang Z, Li C, Jia P, Wu J. Geographic Distribution of Alcohol Use Among Chinese Adults - China, 2015. China CDC Wkly. 2020 Feb 14;2(7):98-103. PMID: 34594833; PMCID: PMC8428418.
15.马冠生,杜松明,胡小琪,等. 我国四城市成年居民夏季水摄入情况[C]// 中国营养学会(Chinese Nutrition Society). 中国营养学会第十一次全国营养科学大会暨国际DRIs研讨会学术报告及论文摘要汇编(下册)——DRIs新进展:循证营养科学与实践学术. 中国疾病预防控制中心营养与食品安全所;上海市疾病预防控制中心;江门市鹤山市疾病预防控制中心;成都市疾病预防控制中心;北京市怀柔区疾病预防控制中心;, 2013: 2.
16.Zhang M, Ma Y, Xie X, Sun M, Huang Z, Zhao Z, Zhang X, Li C, Gao X, Wu J, Wang L, Zhou M, Wen D. Trends in insufficient physical activity among adults in China 2010-18: a population-based study. Int J Behav Nutr Phys Act. 2023 Jul 17;20(1):87. doi: 10.1186/s12966-023-01470-w. PMID: 37460936; PMCID: PMC10351178.
17.Strain T, Flaxman S, Guthold R, et al. National, regional, and global trends in insufficient physical activity among adults from 2000 to 2022: a pooled analysis of 507 population-based surveys with 5·7 million participants. Lancet Glob Health. 2024 Aug;12(8):e1232-e1243. doi: 10.1016/S2214-109X(24)00150-5. Epub 2024 Jun 25. PMID: 38942042; PMCID: PMC11254784.
18.Zhuang Z, Tong M, Clarke R, Wang B, Huang T, Li L. Probability of chronic kidney disease and associated risk factors in Chinese adults: a cross-pal study of 9 million Chinese adults in the Meinian Onehealth screening survey. Clin Kidney J. 2022 Aug 3;15(12):2228-2236. doi: 10.1093/ckj/sfac176. PMID: 36381363; PMCID: PMC9664583.
19.https://www.czapp.com/zh/analyst-insights/%E4%B8%AD%E5%9B%BD%E9%A3%9F%E7%B3%96%E6%B6%88%E8%B4%B9%E5%9C%A8%E6%9E%9C%E8%91%A1%E7%B3%96%E6%B5%86%E7%AB%9E%E4%BA%89%E4%B8%8B%E6%8C%81%E7%BB%AD%E5%A2%9E%E9%95%BF/
20.https://www.chyxx.com/industry/1166760.html
21.刘晓雪,岳俊秀,王慧娟. 全球高果糖甜味剂生产的发展格局与区域特点 [J]. 中国糖料, 2021, 43 (02): 76-81. DOI:10.13570/j.cnki.scc.2021.02.013.
22.James N. BeMiller, Roy L. Whistler. Starch: Chemistry and Technology, Third Edition. Academic Press.2009
23.Huang Y, Chen Z, Chen B, Li J, Yuan X, Li J et al. Dietary sugar consumption and health: umbrella review BMJ 2023; 381 :e071609 doi:10.1136/bmj-2022-071609
24.https://www.mayoclinic.org/zh-hans/diseases-conditions/gout/symptoms-causes/syc-20372897
25.Grayson PC, Kim SY, LaValley M, Choi HK. Hyperuricemia and incident hypertension: a systematic review and meta-analysis. Arthritis Care Res (Hoboken). 2011 Jan;63(1):102-10. doi: 10.1002/acr.20344. PMID: 20824805; PMCID: PMC3016454.
26.Su H, Liu T, Li Y, Fan Y, Wang B, Liu M, Hu G, Meng Z, Zhang Q. Serum uric acid and its change with the risk of type 2 diabetes: A prospective study in China. Prim Care Diabetes. 2021 Dec;15(6):1002-1006. doi: 10.1016/j.pcd.2021.06.010. Epub 2021 Jul 1. PMID: 34217642.
27.Kanbay M, Jensen T, Solak Y, Le M, Roncal-Jimenez C, Rivard C, Lanaspa MA, Nakagawa T, Johnson RJ. Uric acid in metabolic syndrome: From an innocent bystander to a central player. Eur J Intern Med. 2016 Apr;29:3-8. doi: 10.1016/j.ejim.2015.11.026. Epub 2015 Dec 15. PMID: 26703429; PMCID: PMC4826346.
28.Biradar, M.I., Chiang, KM., Yang, HC. et al. The causal role of elevated uric acid and waist circumference on the risk of metabolic syndrome components. Int J Obes 44, 865–874 (2020). https://doi.org/10.1038/s41366-019-0487-9
29.Chang BS. Ancient insights into uric acid metabolism in primates. Proc Natl Acad Sci U S A. 2014 Mar 11;111(10):3657-8. doi: 10.1073/pnas.1401037111. Epub 2014 Feb 20. PMID: 24556992; PMCID: PMC3956182.
【本文由投资界合作伙伴微信公众号:果壳硬科技授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






