3月9日晚,中国医药(600056)发布与辉瑞公司签订供货协议的公告,称公司将在2022年负责辉瑞新冠病毒治疗药物PAXLOVID™在中国大陆市场的商业运营。至于“商业运营”包含的具体项目、权益分配等,合作双方都表示以公告为准,尚未进一步披露。
尽管公司预计“相关业务规模占公司整体业务量比重较小,对公司近期经营业绩无重大影响”,且曾披露由于出口防疫业务大幅下降,2021年净利润预计同比减少77%到47%;但“新冠口服*药概念股”依然强势:10日开盘,中国医药一字涨停,自3月2日以来,公司累计涨幅超过70%。
2月11日,Paxlovid(奈玛特韦片/利托那韦片组合包装)在美国紧急获批上市50天后,通过中国药监局应急审批,附条件批准辉瑞进口注册该新冠口服*药。辉瑞Paxlovid获批上市后,拉动了CDMO企业凯莱英、博腾股份,及雅本化学等的股价表现,此次中国医药获得Paxlovid商业运营权前后,也是受到资本市场热捧。
在防治新冠疫情方面,“检测+疫苗+治疗药”缺一不可,中国的核酸检测、疫苗供应充足;治疗方面,此前虽有注射给药的中和抗体药物获批,但临床上需要疗效更好、给药方式更灵活的小分子抗病毒药物。新冠口服*药的推广,有望补齐逐步开放国门的拼图。
01、Paxlovid在中国大陆的合作商业开发
中国医药健康产业有限公司,由央企通用技术集团控股,业务涉及医药商业、国际贸易、医药工业;2021年上半年中国医药的商业、国际贸易两个板块分别贡献了68%、24%的营收,也是公司营业利润的主要来源。2021上半年中国医药的国际贸易业务营收、利润同比大幅下降,公司表示主要由于海外防疫业务同比减少导致。
作为一家医药流通上市企业,中国医药主要服务医院等行业客户,在大众媒体中鲜有发声(与国药集团并非一家公司)。此次获得辉瑞Paxlovid在中国大陆的商业运营权,公司方面强调通用技术中国医药作为医药行业国家队和主力军,将全力推进新冠口服治疗药物落地。
目前,关于Paxlovid在中国的定价情况,尚无定论。据辉瑞官网消息,美国政府*批采购的1000万个疗程的新冠口服药,斥资52.95亿美元(约合337亿元人民币),折合单个疗程价格3370元人民币。
辉瑞表示在提供Paxlovid时,对95个低收入国家不收取特许权使用费;并计划根据各国的经济收入不同,采用阶梯式的价格。中国并不在可低价仿制的95个国家范围内,Paxlovid在中国的具体售价,也需观望中国医药和辉瑞的洽谈情况。
创新药的商业运营,涉及代理商权益、临床推广、配送等多个环节。目前来看,Paxlovid作为小分子抗新冠病毒药物,仍存在味觉受损、腹泻、高血压和肌肉疼痛等副作用,短期内临床应用场景应还在医院。一位医药行业人士向36氪表示:辉瑞的临床学术推广体系已经很完备,从需求上看,不太需要其他厂商帮助做临床推广,需要的主要是配送。
另据多家行业媒体报道,3月5日辉瑞中国发布内部信,称医院急症事业部将“肩负Paxlovid在中国的商业化重任”,从专业能力的配置看,双方共同进行商业化开发不无可能。
需要注意的是,新冠口服药的商业逻辑与疫苗、检测等不同,疫苗和检测的是全民范围的使用,口服*药则主要针对感染确诊病例。目前在外防输入、内防反弹的严控下,中国大陆的感染率很低,Paxlovid用于当下治疗的销售有限。中国医药在公告中也强调,“预计相关业务规模占公司整体业务量比重较小。”
02、Paxlovid的未来潜力
不过,长远来看,Paxlovid在中国的潜力不应被低估,新冠口服*药的推广,有望补齐逐步开放国门的拼图。后续防疫策略改变之后,相关情况也可能发生改变。根据行业媒体医药笔记整理的数据,近日在美国分发的新冠口服药中,由于疗效数据更好,辉瑞的Paxlovid双周分发药量,已经超过更早开始分发的默沙东Molnupiravir。
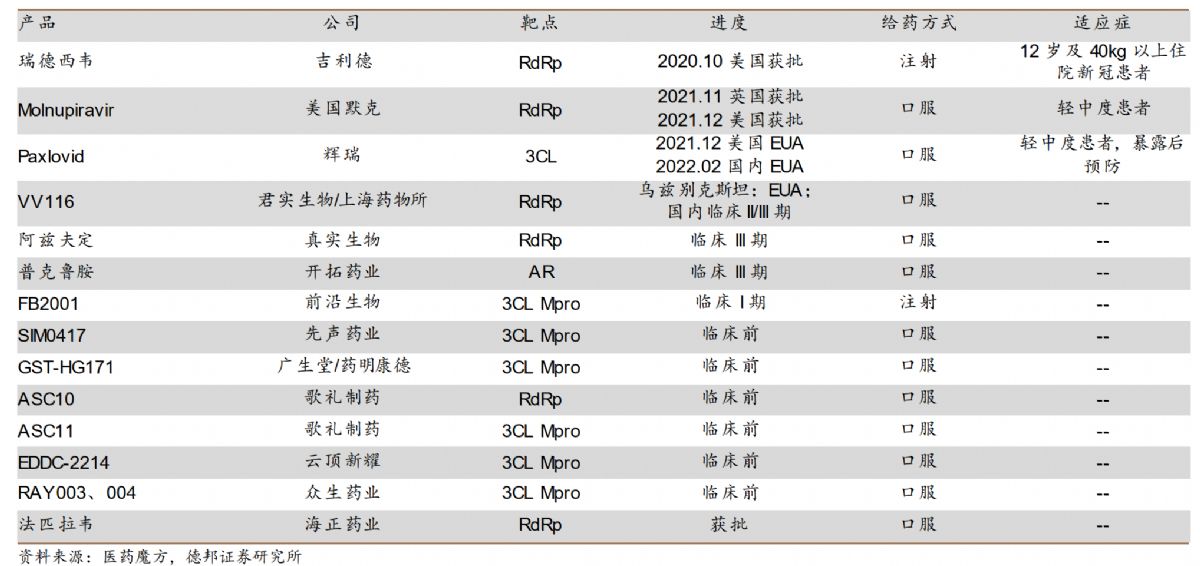
国内外小分子药研发进度
从当前的数据来看,在2/3期临床试验中,Paxlovid使5天内出现新冠症状、并接受治疗的患者,住院或死亡风险降低88%;接受治疗患者在28天随访期间,住院或死亡概率由6.3%降低至0.8%。且辉瑞表示,Paxlovid对奥密克戎变异株有效;相比于抗体药物的效果会随新变异株的出现而下降,小分子抗病毒药物确实更具优势。
相比于静脉注射药品,Paxlovid作为口服小分子药物,给药更为方便。使用方式上,辉瑞获批的新冠抗病毒复方疗法,需要每日服用两次(间隔12小时),每次三片(两片“Nirmatrelvir”和一片“Ritonavir”),需服用五天。
在2021年12月紧急批准时,FDA表示,这款药物适用人群需不小于12岁、体重不低于40公斤,且新冠病毒直接检测的结果为阳性。以及Paxlovid的授权不包括危重症新冠患者的治疗,也并不能代替疫苗,用于新冠暴露前后的预防。不过,当前辉瑞仍在开展Paxlovid用于暴露后预防的相关临床试验,后续有潜力获批该适应症,则可能被用于密接、次密接人群的预防。
就在3月9日,辉瑞在官网宣布,已启动一项新冠口服药Paxlovid的2/3期研究,评估其对于未住院但已确诊新冠且有可能发展为重症的儿童患者的安全性、药代动力学和功效。这项2/3期试验约有140名18岁以下的儿科参与者。
从作用机理来看,Paxlovid是奈玛特韦、利托那韦的复方制剂。前者可以阻断冠状病毒复制所需的SARS-CoV-2-3CL蛋白酶活性,进而阻断病毒复制;利托那韦则是为一种HIV治疗药物,低剂量的利托那韦可有助于减缓PF-07321332的代谢或分解。
产能方面,在掌握详细的合成路径之后,成熟的仿制药企就可以生产小分子抗病毒药物,更利于规模化推广。相比之下,新冠病毒中和抗体需要专门的生物制药企业生产,要求更高。
早在默沙东临床数据揭盲后,辉瑞宣布将新冠口服药Paxlovid的产能从5000万提高到8000万。今年2月,辉瑞又在电话会议中指出,2022年上半年Paxlovid产量将达3000万个疗程,全年为1.2亿疗程。
相比而言,承接新冠口服*药海外产能的凯莱英、博腾股份,合同和业绩的增长更加实在。2021年凯莱英披露了两笔小分子化学新药的巨额供货合同,金额分别为4.81亿美元、27.20亿元人民币。博腾股份分别于2021年11月、2022年2月公告获得2.17亿美元、6.81亿美元订单,订单供应时间截止2022年。
在抗病毒药物方面,中国也有多款候选药物进入临床前研究及临床试验,其中,君实生物的VV116已经在乌斯别克斯坦获批紧急使用,即将进入国际多中心的三期临床试验;另外前沿生物(FB2001,注射剂)进入一期临床试验;歌礼制药的ASC11计划2022年下半年在中 美申报IND。需要注意的是,国内药企自研或引入的新冠口服*药,都是全球权益。
【本文由投资界合作伙伴36氪授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






