一个新靶点的成功,往往来自药企孤注一掷的投入和漫长时间里的等待。然而,更多的药企都选择在成熟靶点中沉沦,只有少数药企愿意冒险,去尝试征服那些难度更高的靶点。
HER3靶点便属于难度更高的靶点。HER3与明星靶点EGFR、HER2同属HER家族,前两者早在多年前就已成药,HER3则由于结合力低、内在激酶活性极低等问题迟迟无法成药。
从1989年HER3靶点被发现到现在,30年时间里,包括罗氏、安进、*三共在内的多家大药企都曾折戟于此。
宿命般的失败固然吓退了不少人,但创新药研发向来不缺孤勇者,仍然有人在坚持开发HER3靶点。
随着研发人员对HER3的作用机制洞察更加深刻,叠加ADC、双抗技术的发展逐渐成熟,一度陷入晦暗的HER3药物,如今再度绽放光芒。
当然,HER3距离成药还有多远?若能成药,HER3的想象空间又会不会像HER2、EGFR一样大?
这些问题暂无定论,但可以肯定的是,在过去30多年里,一群非常聪明的研究人员付出了自己的时间,赌上了自己的骄傲,一同探索这一潜力靶点。他们一直在坚持,所以今天比昨天,明天比今天,HER3与成药之间的距离,又近了一些。
01 “怪胎”也有春天
人表皮生长因子受体是一个小家族,有4位成员——HER1、HER2、HER3和HER4。作为跨膜蛋白,它们可以在细胞表面与生长因子结合,进行信号传导,调节细胞的生长、分裂和修复,并与许多癌症的发展息息相关。
在人类征战癌症的历史中,大量研究跟临床试验表明,HER2相比其他靶点更具治疗意义,比如大名鼎鼎的曲妥珠单抗;EGFR也是非小细胞肺癌(NSCLC)领域的兵家必争之靶点。
同为HER家族成员,在这两个明星靶点对比下,HER3显得颇有几分默默无闻。
与其他成员相比,HER3可以说是个家族“怪胎”,其细胞内酪氨酸激酶活性极弱,比完全激活的EGFR激酶活性弱1000倍。
正是由于HER3酪氨酸激酶结构域活性极低,导致研发人员一度认为HER3完全依赖于其家族成员的活性,HER3本身并没有什么太重要的职能。所以,在癌症治疗中,HER3这一靶点很长一段时间内,都被无视了。
但随着研究的深入,科学家发现这个不起眼的HER3,也是个“叛徒”。在针对多种实体瘤的两项系统性分析表明,HER3表达与总生存期相关。与HER3阴性患者相比,表达HER3的患者死亡风险高1.6倍。
事实上,虽然与其他家族成员相比,HER3单独过表达时不具有致癌作用,但是,当HER3与神经调节蛋白(NRG)配体结合后,便会与其他RTK(受体酪氨酸激酶)形成异源二聚体。
尤其是当HER3与HER2两兄弟接上头,变会形成HER2:HER3异源二聚体,导致PI3K/AKT和MEK/MAPK信号通路会被激活,促进细胞的分裂、增殖与分化,促进癌细胞的存活和发展。
所以,阻断HER3靶点与NRG的结合,或是阻断HER2与HER3形成异源二聚体,理论上也能够抑制癌症的发展。
更重要的一点是,HER3已经被证明与EGFR、HER2疗法的耐药机制有关。
有研究认为,HER2、HER3 、IGF1R之间的异源三聚体形成,是乳腺癌细胞中驱动的曲妥珠单抗耐药性的主要诱导剂。在研究中敲除HER3后,癌细胞对曲妥珠单抗重新敏感。此外,NRG1刺激也会在HER2过表达乳腺癌细胞中诱导曲妥珠单抗耐药。
而对于EGFR耐药,在HER家族中观察到广泛的串扰和信号可塑性,即一个受体发出的信号被阻断,另一个受体可能会进行补偿。所以,同时靶向包括HER3在内的多个HER家族靶点,成为破解EGFR耐药的可能方法。
HER3很可能会成为破解EGFR、HER2耐药性的一把钥匙。鉴于HER2、EGFR耐药的广泛发生,如果HER3能够解决这一耐药问题,那么将会满足极大的临床未满足需求。在这一背景下,HER3药物的研发就显得十分必要,“怪胎”也迎来了春天。
02 不断涌现的拯救者们
由于HER3内在激酶活性极低,无法被制成小分子激酶抑制剂,单抗便成为HER3研发的起点。
包括*三共的U3-1287、罗氏的RO5479599在内的多款HER3单抗相继进入临床试验。遗憾的是,围绕着HER3单抗的研发基本都以失败告终。临床试验发现,这些HER3单抗普遍有效性不足。
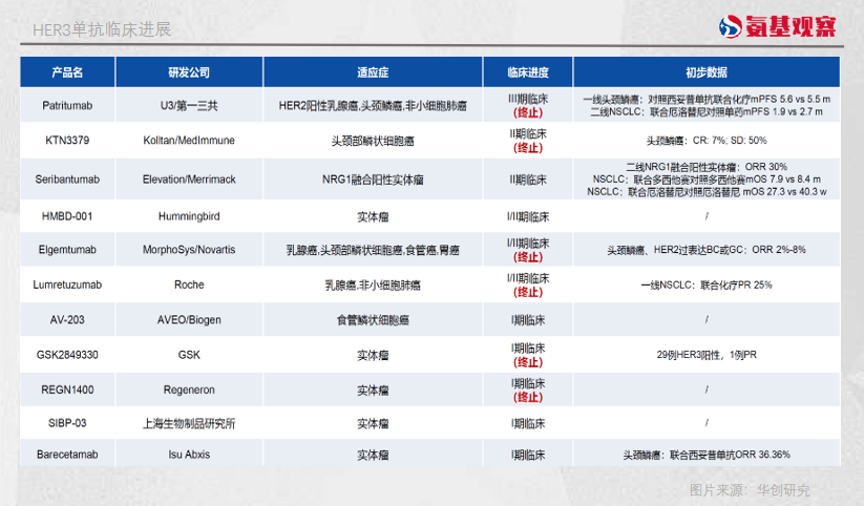
HER3药物的研发也由此进入了一段冷静期。随着ADC、双抗等技术逐渐成熟,HER3的药物研发又迎来了第二春。
目前来看,HER3靶点最有希望的成功在于ADC药物。由于HER3单抗通过结合HER3,阻挡NRG配体发挥作用,但HER3结合力较低可能会影响药效。相比于单抗,ADC的优势是通过诱导受体内吞和降解导致癌细胞死亡,不必完全依赖HER3诱导癌细胞死亡。
如今有两款HER3 ADC处于临床阶段,一款是*三共的U3-1042,另一款是百利天恒的EGFR/HER3 双抗ADC药物BL-B01D1。其中U3-1042进度最快,已经进入三期临床。
U3-1042与DS-8201使用了相同的结构,在2023年日本肿瘤内科学会(JSMO)年会期间,*三共公布了U3-1042的一期临床试验数据。
其中,针对非小细胞肺癌的数据显示,中位随访23个月,5.6 mg/kg U3-1042组患者的客观缓解率(ORR)为40.2%,无进展生存期(PFS)为6.4个月,总生存期(OS)为15.8个月。
值得注意的是,这一结果针对的是已平均接受过4线治疗的患者,超过15个月的总生存期,对于晚期或转移性如EGFR突变NSCLC患者来说,已经算是史无前例的数据。
尤其是对待EGFR耐药患者,U3-1402的客观缓解率也达到了39%,中位缓解持续时间达到6.9个月,无进展生存期达到8.2个月。
双抗则是另一条HER3可能走通的道路。尽管HER3的酪氨酸激酶活性非常低,但它被认为是其他表皮生长因子受体的重要辅助受体和变构激活剂。在这种情况下,HER3双抗成为对抗EGFR、HER2耐药的种子选手。
此前,Merrimack 的MM-111、MM-141、罗氏的MEDH7945A都曾在此折戟,但也有一些双抗选手正显现出潜力。比如Merus的HER2/HER3双抗MCLA-128。
MCLA-128可以与肿瘤细胞上大量表达的HER2结合,并通过与HER3结合阻断人表皮生长因子受体调节蛋白刺激的肿瘤生长,这种双靶向机制增加了药物对癌细胞的特异性。
在2022年ASCO年会上,Merus公布了MCLA-128治疗NRG1融合肿瘤的二期临床数据。结果显示,71例可评估患者的客观缓解率为34%,其中针对NSCLC患者的客观缓解率为35%。
此外,靶向HER3的疫苗也处于临床前研究中。HER3疫苗在临床前评估中,Ad-HER3-FL诱导强烈的T细胞抗肿瘤反应。Ad-HER3-FL与双PD-1/PD-L1和CTLA-4 联合疗法也展示出了对抗癌症的高效性。
在各种新疗法的不断尝试下,HER3距离成药又近了一步。
03 能否成为下一个HER2
如今,不少人对于HER3靶点抱着极高的期待,希望它能像同门HER2靶点、EGFR靶点一样争气。HER3靶点能成为下一个HER2靶点吗?这还是一个未知数。
药物研发快速推进的同时,我们还要看到,与HER2、EGFR相比,HER3成药之路上还有很多不确定性因素。
首先,不管是HER3 ADC还是HER3 双抗,大部分产品都处于早期临床阶段。要知道,早期临床数据亮眼,晚期数据滑铁卢的例子比比皆是,从IDO抑制剂到TIGIT单抗,都是如此。
考虑到过去单抗、双抗在HER3靶点上频繁失败的历史,对于HER3药物的开发,也不能盲目乐观。
其次,识别HER3表达的肿瘤患者。是预测HER3靶向治疗反应的重要一步。虽然HER3的表达通常通过免疫组化进行,但目前还缺少HER3染色的相关标准。
最后,HER3还需要改进生物标志物。
对于癌细胞来说,需要鉴定可以从某种靶向剂中受益的肿瘤亚群,以实现癌症患者的个性化治疗。因此,需要找到肿瘤相关生物标志物以及合适的诊断试剂。
但目前还没有合适的反映HER3激活与否的生物标志物,即使是在对HER3配体NGR1进行筛选后,药物的应答率仍然较低。
虽然HER3药物的研发还有不少不确定性,但不可否认,HER3靶点的潜力所在。国内信立泰、百利药业、轩竹医药等药企也对HER3药物研发进行了布局。
随着对HER3靶点研发的持续进行,HER3失败的命运终将成为历史,HER家族也将迎来新的明星成员。
【本文由投资界合作伙伴微信公众号:氨基观察授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






