又一批械字号产品明确监管类别!
日前,国家药品监督管理局医疗器械标准管理中心对外发布《2023年第二次医疗器械分类界定结果汇总》(以下简称“《结果汇总》”)。其中汇总的医疗器械产品分类界定结果共249个,涵盖了今年1月至4月医疗器械产品。
《结果汇总》中,有超20款医美器械产品的判定界限有所变动,加上不久前发布的《2023年*次医疗器械分类界定结果汇总》,此次监管部的动刀的目标很清晰——械字号的医用敷料类产品。
01 医用敷料变动*
《FBeauty未来迹》梳理发现,一共有13类产品被纳入II、III类医疗器械管理中,数量上以《第二次结果汇总》为主,占10款。整体来看,可以发现两大关键点:
*,7类产品可能被“剔”出械字号。
在最新《结果汇总》中,包含“重组人源化胶原蛋白”的重组胶原蛋白液体在内的7类产品建议不作为医疗器械管理。换而言之,此类产品可能会被“踢”出械字号范畴。
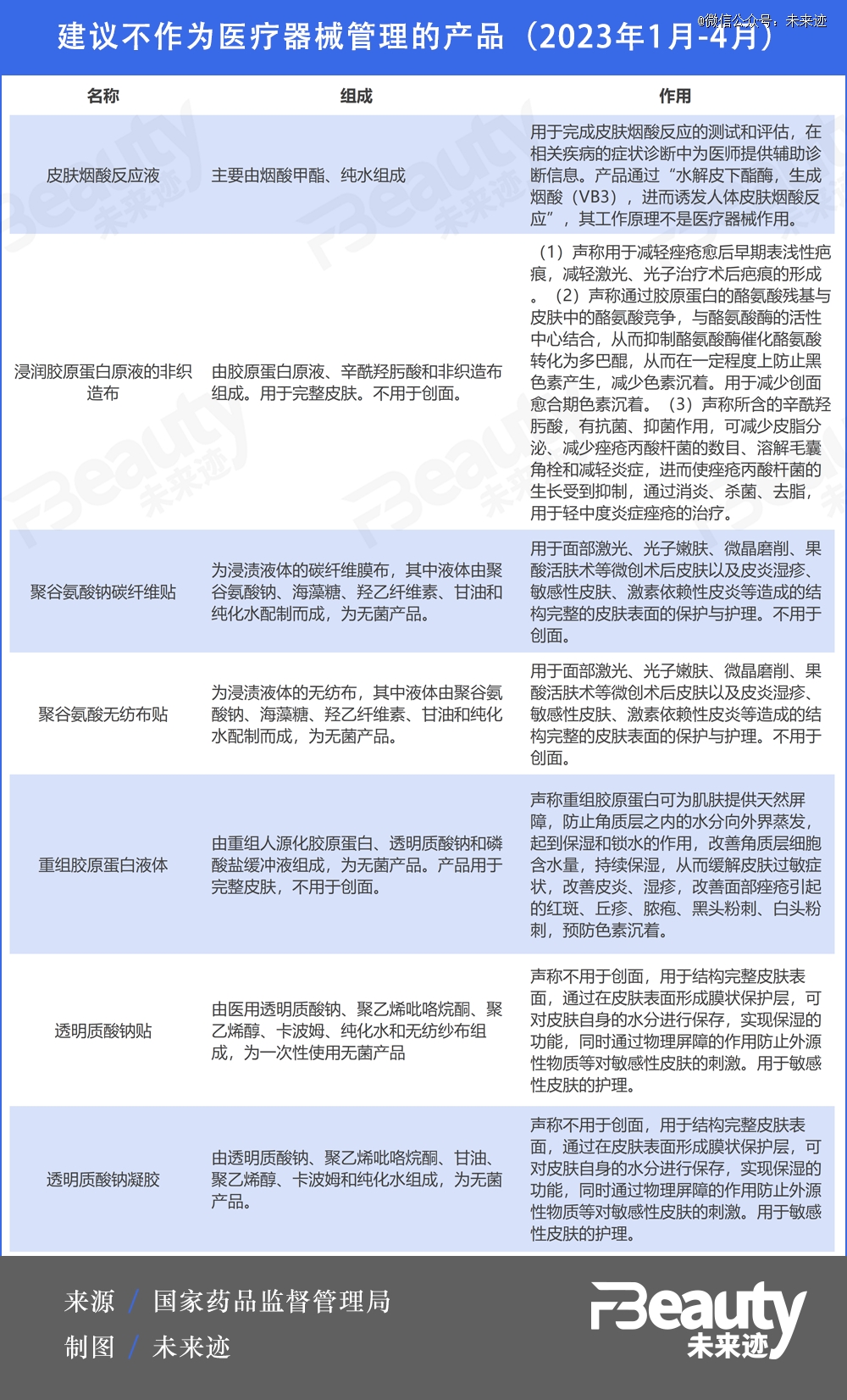
文件表述十分清晰,这7类产品因为不用于创面,或是只用于结构完整的皮肤表面的保护与护理而被建议不纳入械字号管理。是否接触创面、接触创面的程度成为此次《结果汇总》对械字号分类调整的重要依据。
第二,部分医用重组胶原蛋白类敷料列入II类医疗器械。
根据国家药监局发布的《外科纱布敷料通用要求》定义,医用敷料主要用于清洁覆盖创面、吸收体内渗出液、为创面提供愈合环境,部分医用敷料还可用于手术过程中支撑器官或组织,在医疗卫生领域起着重要作用。近些年来,医用敷料在化妆品行业应用火热。
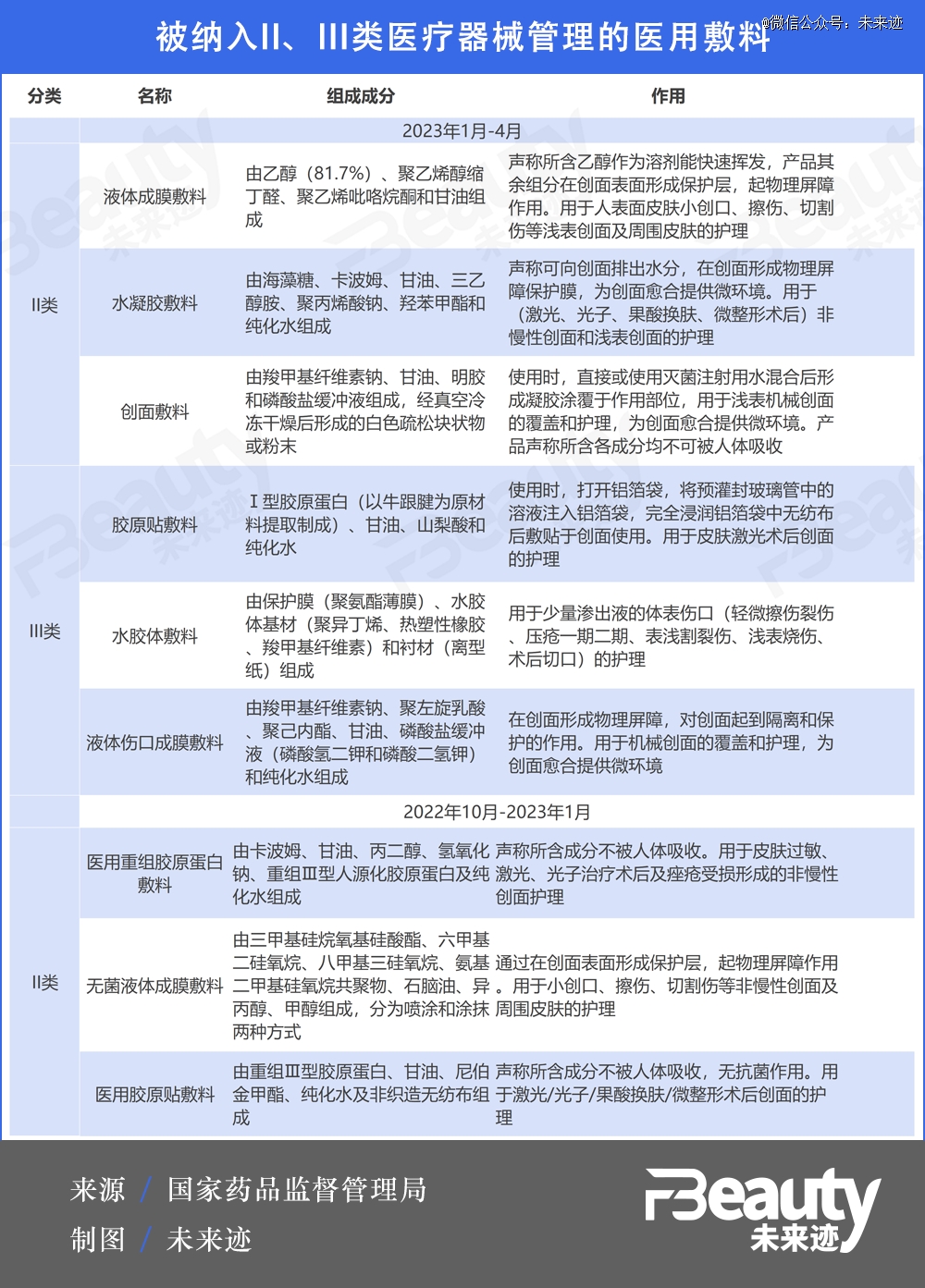
这两次《结果汇总》中,一共新增9款医用敷料,被列入II、III类医疗器械管理。其中胶原蛋白类敷料为监管重点。
其中,II类医疗器械中的三款医用敷料都为《*次结果汇总》发布,包含两款胶原蛋白类敷料。一款名为“医用重组胶原蛋白敷料”,由卡波姆、重组Ⅲ型人源化胶原蛋白、甘油等物质组成,用于皮肤过敏、激光、光子治疗术后及痤疮受损形成的非慢性创面护理;另一款名为“医用胶原贴敷料”,由重组Ⅲ型胶原蛋白、甘油、尼伯金甲酯等物质组成,用于激光/光子/果酸换肤/微整形术后创面的护理。
除了胶原蛋白类原料之外,国家也正在对更多种类的医用敷料展开严管,例如将用于激光、光子等医美术后非慢性创面和浅表创面护理的水凝胶辅料纳入III类医疗器械。
简而言之,细微创面的医用敷料被列为II类医疗器械管理,较大创面或较高风险的创面护理的医用敷料被列入III类医疗器械严管。
02 细化分类,严格监管,已有企业提前布局调整
可以看出,国家正在逐步完善对医用重组胶原蛋白的监管,并对管理范畴进行细化管理。而与此同时,械字号被摆到放大镜下“微操式”管理,也意味着相关管理会更为严格。
首先“动刀”的地方是,将一些曾经被划为III医疗器械的医用敷料被降级为II类,包含“重组人源化胶原蛋白”的重组胶原蛋白液体以后可能不能作为医疗器械销售。
事实上,械字号的分类对于此类产品有着重要的意义。
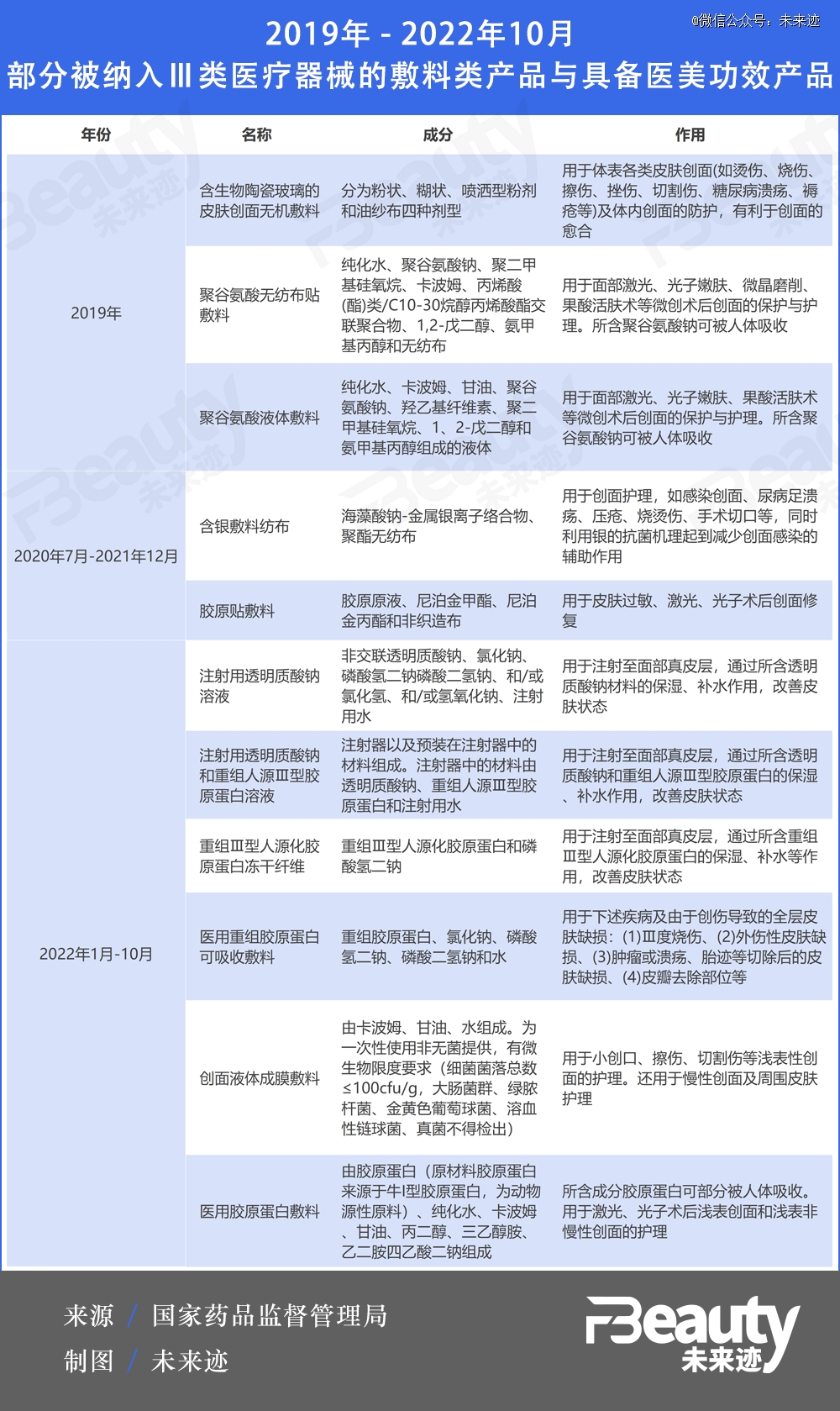
纵观近些年的新增情况不难发现,自2020年开始,胶原蛋白类敷料就一直是III类医疗器械的“座上宾”。
此前,在2022年国家药监局发布的1-6月《结果汇总》中,将“医用重组胶原蛋白可吸收敷料”纳入了III类医疗器械的管辖范围中。但其应用范围明确界定为:用于下述疾病及由于创伤导致的全层皮肤缺损:(1)Ⅲ度烧伤、(2)外伤性皮肤缺损、(3)肿瘤或溃疡、胎迹等切除后的皮肤缺损、(4)皮瓣去除部位等。
与此同时,III类医用敷料因壁垒较高和稀缺性,拥有更高的溢价空间,II类医用敷料热销榜单中的产品价格带在55元-200元之间,低于III类医用敷料200元向上左右的价格,不乏部分品牌试图用更高的械字号分类获取更高的溢价。
《FBeauty未来迹》观察发现,目前市面上的大多数医用敷料类产品均属于II类医疗器械,例如敷尔佳“白膜”“黑膜”、绽妍“蓝膜”等,III类医用敷料较少。
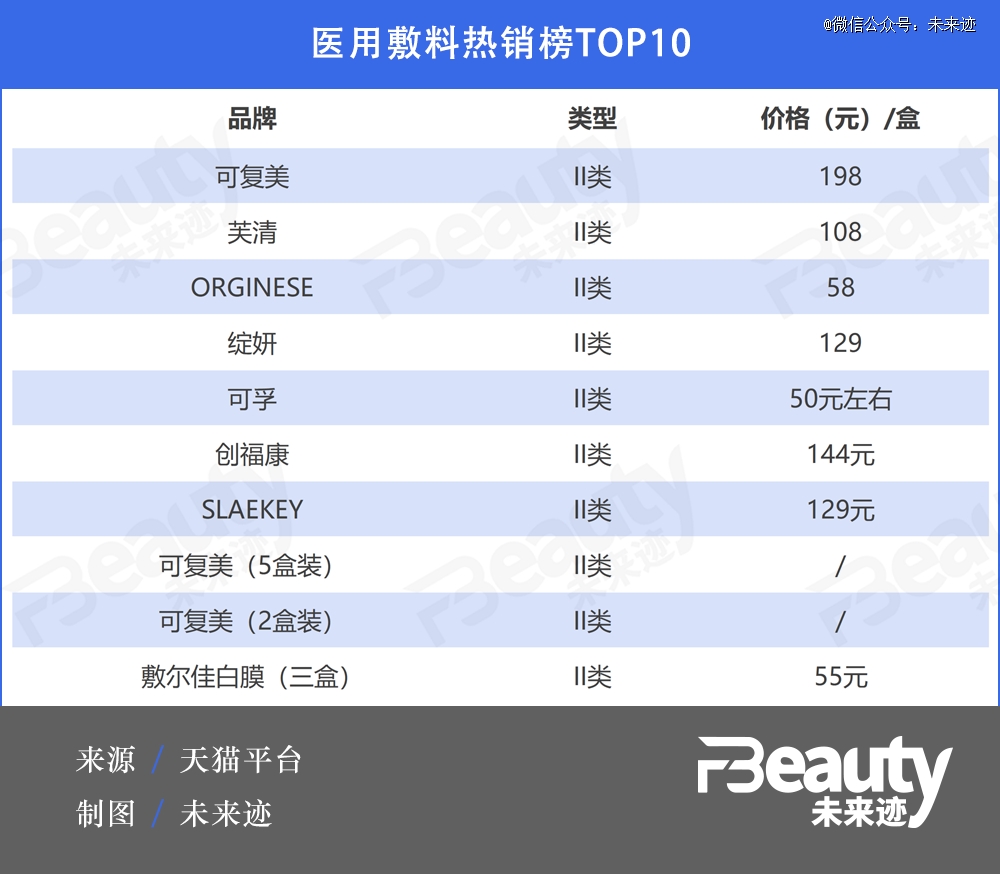
截至7月19日17点,从天猫医用敷料热销榜来看,TOP10排名全都为II类医用敷料,可复美、芙清位居前二,月销量分别超20000、30000件。
但无论是当时还是现在,市面上大量存在的“重组胶原蛋白敷料”都主要用于激光、光子术后浅表创面和浅表非慢性创面护理,故而此类敷料的监管一直未有一个明确的“归宿”。这两次《结果汇总》,是在更加贴近市场的基础上,明确了这类敷料的管辖范畴。
但械字号的分类与消费者的实际需求可能并不匹配,普通消费者的日常美容需求用II类产品即可满足。荃智研究院创始人张太军曾告诉《FBeauty未来迹》,仅用于日常面部护肤、无皮肤病或医美术后需求的消费者,其实没有必要用到III类医用敷料产品。
法规调整越来越多了,更新越来越频繁了,管理得越来越精准了,已经成为当前所有化妆品企业的共识。
2017年9月4日,国家药监局正式发布新修订的《医疗器械分类目录》,此后每隔一段时间都会对医疗器械产品的分类界定结果进行汇总更新。2019年开始,敷料类产品陆续被纳入III类医疗器械管控范畴。
2021年至2023年,国家药监局相继发布了《重组胶原蛋白类医疗产品分类界定原则的通告(2021年第27号)》、《重组人源化胶原蛋白原材料评价指导原则(征求意见稿)》、《重组人源化胶原蛋白》医疗器械行业标准。
2021年国家药监局发布《关于医疗器械分类目录动态调整工作程序的公告》之后,《医疗器械分类目录》可由相关企业及机构提议,不定期进行动态调整。
同时,《分类目录》根据需要进行调整,调整工作原则上每年不少于一次。此次《结果汇总》正是调整工作的进一步落实。
常态化更新且细节越来越多的《结果汇总》,已经在潜移默化中对市场产生影响。
《FBeauty未来迹》了解到,在法规公布前,已经注册过的产品有五年的注册有效期。厂家在这期间还可以继续生产销售,到期后才会受到管控。此外,上述人士还告诉《FBeauty未来迹》,厂家拥有一段时间的“过渡期”。例如注册证书八月份到期的产品,八月份之前生产的东西仍可以正常售卖。
也有行业人士向《FBeauty未来迹》透露,近两年市场上已经有一波生产械字号产品的企业正在转向妆字号,他们似乎已经提前感知到,与其被越来越细分和精准的法规“赶回”妆字号,不如提前布局。
03 良性发展,存在极大市场探索空间
对医用敷料精细化、动态化管理,一方面源于市场乱象,另一方面则源于市场的快速发展。
中泰证券2021年发布的相关研报显示,主要用于轻医美术后的贴片式修护敷料市场规模近50亿元,年均复合增长率(CAGR)达46%。预计2024年,医用皮肤修复敷料消费量达9亿片,医美及敏感肌需求为主要成长拉力。
就在7月19日,国家药品监督管理局发布《关于进一步加强和完善医疗器械分类管理工作的意见》中明确表示,“研究修订《医疗器械分类规则》,为有序调整产品类别奠定基础。针对新材料、高新技术等领域,聚焦监管热点问题、共性问题和急需问题,在分类规则框架下研究细化分类界定指导原则,统一相关领域产品分类界定原则和尺度,服务产业高质量发展。”
在一个越来越热,新技术、新材料迸发的市场里,需要有更及时、更具体的法规监管,职能部分对行业的重视程度也在不断提升,也在打造一个更“接地气”、更细致的法规体系。
但不变的是,“妆是妆、药是药”的监管思路在新规中得到了进一步的延伸。
目前来看,医疗器械和美容行业的交集,大面积集中在“敷料”市场。2020年过后,由于国家药监局对“械字号”乱象的管控,持有II类和III类医疗器械证号的医用敷料才能用于医美或微整形后使用。(详情可见:)。
但职能机构依旧希望市场能够在用于治疗的“械”与日常护理的“妆”之间划出清晰的界限,并在“械”中做出细分。部分企业试图用“械”来塑造“专业、有效、安全”化妆品的形象错位,有望通过械字号的级别调整和剔除得到“医治”。
也有行业人士推测,法规的频繁调整和监管的细致化、严格化,在不断拉高械字号的门槛。
根据《医疗器械监督管理条例》,医用敷料凡是声称无菌的,其管理类别*为II类医疗器械;若接触真皮深层或其以下组织受损的创面,或用于慢性创面,或可被人体全部或部分吸收的,其管理类别为第III类医疗器械。
II、III类产品的生产、监管以及流通环节,都对化妆品企业有极高要求。例如在生产环节,一位资深业内人士告诉《FBeauty未来迹》,一个II类产品申报注册证的最短周期为八个月到一年,这个过程中需要付出大量人力物力财力成本。
此外,大部分II、III类产品需要进行临床实验;实际监管和流通中,II、III类的医疗器械监管执行单位层级更大,对经营场所和贮存条件要求更高,还需另外建立销售记录制度。一套流程下来,一般小型企业硬件和软件都无法达到要求。
绿翊(广州)技术服务有限公司技术法规研究负责人骆传文告诉《FBeauty未来迹》,之所以对胶原类敷料把关严格,主要原因在于过去跟风乱象严重,导致质量普遍下滑。“通常来说,妆转械的企业生产水平较低,均为10万级车间+灌装,并未有实际的原料研究,分子量研究,结构研究,生产过程活性控制研究,热源等情况研究。”
械字产品敷料市场欣欣向荣,在一片向好的市场里,必然会有更多非理性和无序的“探索”,监管部门用法规“园艺剪”来修剪枝丫,修形状、设门槛,显得尤为重要。
【本文由投资界合作伙伴微信公众号:未来迹授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






