自从人类开始解析基因密码后,人们不仅对癌症的认识有极大的突破,话包括其他各类疾病。
基于人类基因从寻找药物靶点开始显现,例如人类人们已经阐明4000多种罕见的单基因疾病,为罕见病治疗提供了要指引。
过去5年中,前15家制药公司推出的329种新活性物质的研究和开发支出达5710亿美元,然而真正获批成为药物的却不足10%。
绝大多数失败原因是缺乏疗效,很大程度上在于好的靶点非常少,要么一窝蜂地做已经验证过的靶点,要么新靶点的风险极大。
选择怎样的靶点,如何选择靶点,已经成为创新药的焦点问题,每家公司都想要风险低且不“卷”的靶点。
一项刊登到Nature的综述显示,基因靶点发现和药物批准之间的中位时间为25年。
是什么导致了这个数值,之后又会遇到怎样的困难?
01 靶点的滞后性
8月23日,Nature发表了一篇文章,来自McGill大学的作者量化研究了从基因靶点到上市批准疗法的时间。
作者分析了40种遗传性质的胚系(germline)基因变异造成的36种罕见病和4种常见病,这些都推进了新的靶点以及批准疗法的产生。这些疾病主要是遗传代谢性疾病,其次为自身免疫病和神经肌肉疾病。
在将药物按类别(小分子、生物或基因治疗)分组后,这40个靶点产生了47种疗法。基因靶点发现和药物批准之间的中位时间为25年,且大多数罕见疾病的基因驱动疗法都是补偿性的,弥补因变异造成的生理功能缺陷。
这40个靶点相当于FDA批准的非癌症药物中约500个药物靶标基因的6%。剩下的94%可能是用传统的药理学、生物化学或分子生物学方法鉴定的。
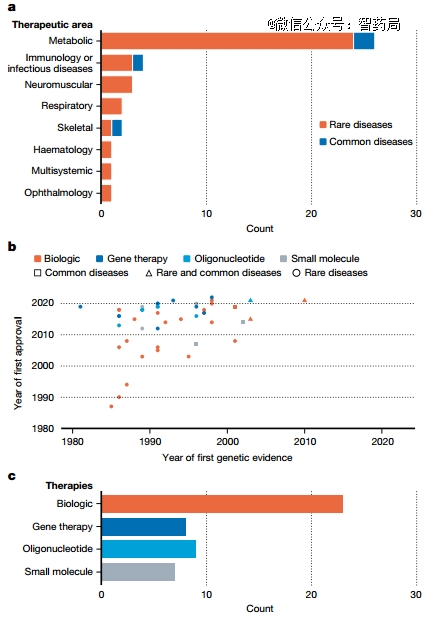
图:由40个基因驱动的非癌症疗法的40个靶点获批的47款药物
而这些基因驱动的新靶点的发现也催生了基因疗法的发展,包括基因编辑、RNAi、ASO等新兴疗法。
其中一个非常著名的例子是PCSK9抑制剂的诞生,2003年法国科学家首次报道了前蛋白转化酶枯草溶菌素9(即PCSK9),在胆固醇代谢方面发挥重要作用。
2015年,FDA批准了*用于该适应症的PCSK9抑制剂,这是在最初的遗传观察发表12年后,现在被用于治疗高胆固醇血症、动脉粥样硬化、急性冠脉综合征、心肌梗塞、卒中等领域。
除此之外,由于基因能够调节多种性状,基因组研究还可以用于药物重定位,重新用于治疗与同一目标基因相关的其他疾病。
例如5α还原酶抑制剂最开始用于治疗前列腺增生,之后被用于预防脱发。IL-23抑制剂,最初是为银屑病开发的,基于通过全基因组关联研究检测与克罗恩病之间的关联,已被重新用于克罗恩病。
对于基因和遗传学上的研究从靶点发现、临床开发(生物标志物)等都有着非常重要的作用,但是它较长的转化过程也限制了基因靶点的开发。
鉴于出现了大量新的、经过基因验证的潜在药物靶点,需要创新的方法来优先考虑正在研究的化合物,以降低其临床开发的成本和持续时间,并增加批准的可能性。
因此需要充分发挥人类遗传学和基因组学的潜力,并带来快速为患者提供有效、安全的创新疗法。
02 需要加大投入
由于能够检测疾病与常见变异之间关联的GWAS技术是在2007年才出现的,这可能也导致基因发现和药物批准之间的平均滞后时间为25年。
从GWAS中确定的位点到药物靶点仍然是一项复杂的工作,需要将基因组学与其他组学方法(如蛋白质组学、表观基因组学、代谢组学或转录组学分析)相结合。
为了发现潜在的新药靶点,需要对成千上万人的外显子组进行测序,并且结合各种表型特征以及医疗健康数据,以便获得最够多的统计支持。
因此建立大型生物样本库就非常重要,包括英国的100,000基因组计划和英国生物样本库,冰岛的deCODE,日本的生物样本库,爱沙尼亚的生物样本库和芬兰的FinnGen。
已经有公司和机构意识到投资该领域的价值,以支持创新、安全和有效的非癌症药物的发现和开发从现有的大型公共项目(如UK Biobank, All of Us和FinnGen)中获取基因组和其他组学数据,以寻找和验证新的药物靶点。
•投资于更多样化的人群
•专注于识别保护性功能丧失变体,作为预防和/或治疗常见疾病的新抑制剂的潜在目标
•生成PRSs并使用极端来丰富易致病或保护疾病的编码变体的携带者库
•扩大孟德尔随机化和PheWAS研究,以证实主要适应症,并确定研究药物的早期潜在靶向安全性信号
•开发新工具,从大型GWAS中识别因果基因
•扩展功能基因组学研究,以验证潜在的新药物靶点
•投资进行更多的研究,以确定罕见致病变异外显率的环境和遗传决定因素,以便更好地对患者群体进行风险分层,并预期临床效益
•考虑药物开发的持续时间、成本和风险,以及有关新基因驱动疗法交付的期望管理
•为不同种族的基因型召回研究建立伦理、法律和社会框架
•开发大型的、多样化的、基于疾病的、深度表型的、与emr相关的队列,并同意为未来的基因型召回研究提供支持
•在不同的治疗领域进行概念验证试验,以证明基因辅助临床开发试验的可行性和效率
•促进在全球公平获得新疗法,以改善健康
这种方法药物开发需要对大量、多样化、深入的群体进行投资经适当同意进行遗传辅助试验的表型个体。将建立一个强有力的框架,促进负责任、可持续的惠益分享。
未来,我们或许可以看到更多更快的基因靶点的出现。
【本文由投资界合作伙伴微信公众号:智药局授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






