肿瘤领域,万物皆可卷。
“IO单抗+ADC”刚刚成为潮流,更前沿的“双抗+ADC”就已经在路上。
机理方面,这样的迭代进程可能已在预料之内,ADC已经在很多适应症领域有序的迭代化疗,而用双抗去迭代单抗也是目前肉眼可见的趋势。
8月6日,*三共和默沙东宣布,双方将扩展现有的全球共同开发和商业化协议,在三种在研DXdADC药物之外添加默沙东的在研多抗MK-6070。
默沙东作为探索“IO单抗+ADC”组合疗法的“先行者”,这一进击举动不仅仅向我们展示了未来ADC药物的联用方向,也告诉我们MNC寻求下一代疗法合作的迫切性,
同样,那些有想象力且适应症比较匹配的双抗和ADC,未来都有可能进行“联姻”,产生大额的BD交易来惠及投资者们。
01 联用回眸——单抗+化疗为始
事实上,从主流单抗PD-1诞生时,它的各种联用就从来没有断过。
在原理方面,化疗药物的作用一般是抑制细胞内的有丝分裂亦或是转录,翻译的过程,这种方式的底层逻辑是癌细胞的分裂和以及内部蛋白质的合成比正常细胞要活跃非常多,因此通过细胞毒素的抑制细胞分子DNA或者RNA合成的打击对象就是癌细胞。但是,这样的无差别打击会让正常细胞同时受到损害,这是化疗后患者身体变差的原因。
而单抗则是免疫疗法。以最为大家所熟知的PD-1和PD-L1为例,PD-1是在T细胞表面的免疫检查点受体,激活会导致对机体肿瘤免疫调节的下调,而PD-1抑制剂就是为了抑制这一过程,从而激活肿瘤特异性T细胞对肿瘤的细胞免疫。PD-L1则是肿瘤细胞上PD-1的配体:受体和配体是钥匙和锁的关系,PD-L1通过与T细胞接触,下调T细胞的免疫功能。而PD-L1抑制剂可以阻断肿瘤细胞表面PD-L1与T细胞PD-1的结合能力,从而激活T细胞。与PD-1抑制剂比起来,PD-L1的专一性更强,不会影响PD-1和PD-L2的结合。
而从K药帕博利珠单抗诞生时起,它在III期临床与化疗联用时的对照组一直都是化疗单用,从联用对比弹药中,来确定免疫疗法带来的对化疗疗效的大幅提升。以K药联用化疗治疗非小细胞肺癌的III期临床试验——KeyNote-189为例,OS曲线如图所示:
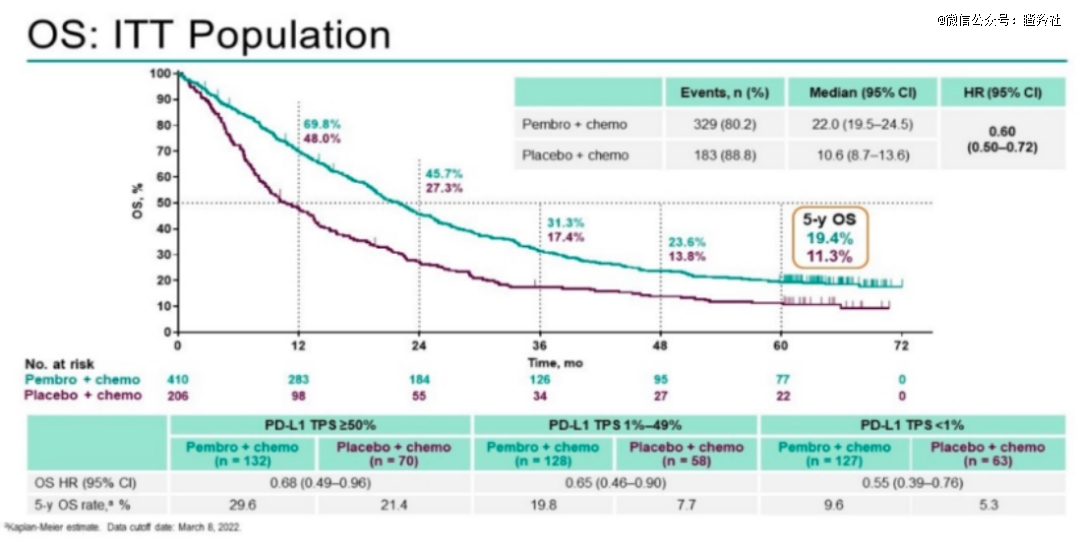
在这次为K药带来一个患者人数庞大适应症市场的III期临床中,试验组和对照组的中位总生存期分别为22.0个月和10.6个月,5年生存率分别为19.4%和11.3%,带来了显著差异化的治疗效果。
随后,一个接一个K药联用化疗的III期临床试验接踵而至。PD-1单抗+化疗联用迅速被医院端所接受。PD-1单抗与化疗的联用大大拓宽了单抗的适应症,为K药登顶药王宝座起到了巨大的助力作用。
免疫疗法联用化疗的缘起,无过于此。
02 毒素+免疫——二者的迭代升级
在大多数肿瘤的治疗上,除去大多数小分子靶向药以及紫杉醇外,联用的进化史就是细胞毒素和免疫疗法二者不断迭代的历史。毒素方面,曾经有过很多试错,后来跑出来的,是ADC这条方向,用靶向特定抗原的方式来减少毒素对身体的损害,但化学毒素杀伤细胞本身这点不变。将细胞毒素导向癌细胞,这点它比化疗做得更好,安全性也高很多。
但目前为止,正如K药刚被批时被用来单药治疗一样,目前ADC在FDA的适应症获批中也大多为单药治疗。新事物每次出现,总是在从保守中慢慢迭代的。
正因为此,研究者们也在打开想象力空间,ADC迭代化疗和单抗联用迅速成为了热门的临床方向。在原理层面,《Trends in Cancer》(2023年IF=9.6)上发表的综述《Combining antibody-drug conjugates with immunotherapy in solid tumors: current landscape and future perspectives》中,阐述了ADC联用免疫药物的优越性。目前免疫疗法和ADC互相叠的buff多种多样。
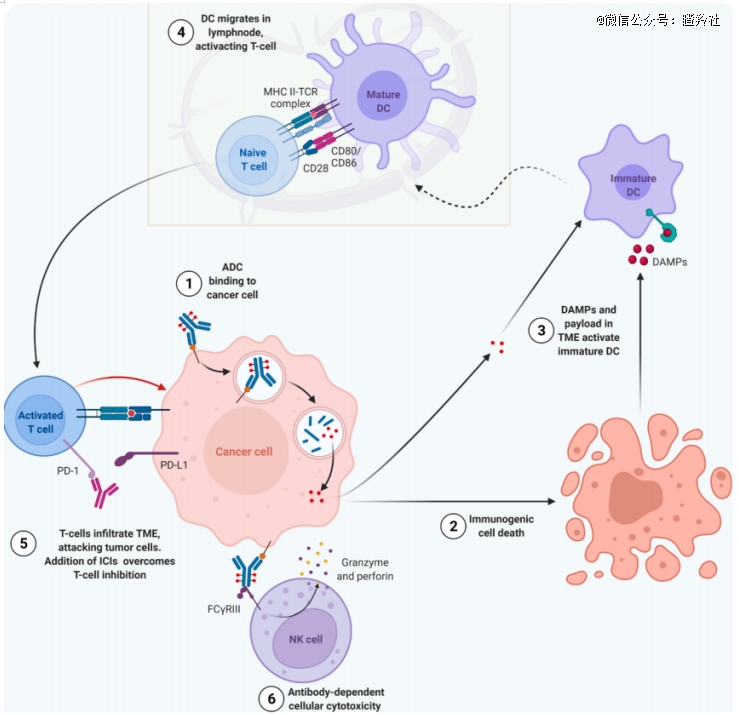
根据综述,一方面,当毒素被释放进入肿瘤微环境中,杀伤肿瘤细胞的过程可以促进未成熟的最强抗原识别细胞——树突状细胞走向成熟,然后他们会去激活最终杀灭肿瘤的角色——还处于未成熟期的T细胞。正是从这个机理出发,ADC具有间接激活细胞免疫过程的效果。
另外,目前学术界共识的方式还有ADC能通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬(ADCP)和补体依赖性细胞毒性(CDC)激活细胞免疫防御,其中,ADC的抗体Fc部分被认为深度参与了该过程。这些方式让ADC深度地参与了细胞免疫的阶段,与前文所述的树突状细胞激活T细胞相互补充,共同增强细胞免疫,让IO疗法发挥更强的作用。
目前,已经有ADC在这方面取得了耀眼的数据。padcev已经成功和K药双向奔赴。
在临床试验KEYNOTE-869中,适应症为尿路上皮癌的患者被分为两组,分别用padcev联用K药治疗(n=76)和单独用padcev(n=73)治疗。根据盲审委员会(BICR)确认的结果,试验组的ORR达到了64.5%,有10.5%获得了完全缓解;而对于对照组而言,ORR 为 45.2%,4.1%获得完全缓解。
惊艳的疗效促使FDA在2023年4月3日加速批准该联合疗法上市,这使其成为了*获批的ADC+IO的联合疗法,这也意味着全球ADC+IO疗法商业化时代的开始。
而在随后的III期临床中,该联合疗法虽然没有像KEYNOTE-869一样做联用和ADC单药的对照,但联用疗法在一线对比化疗的过程中也取得了非常惊艳的数据:mPFS的数据为12.5个月VS 6.3个月,mOS的数据为31.5个月VS 16.1个月。
ADC+IO疗法的联用,使得深耕ADC和深耕抗体的药企们大大拓展了合作的空间。在国内,也有药企早早布局这一领域。最为典型的是荣昌生物的RC48与PD-1联用治疗一线尿路上皮癌,这也是国内联用疗法中跑得最快最为*的选手。
迭代之路走到今天,联用的热潮终于卷到了双抗。因为双抗,是比单抗更加优异的下一代选择。
TCE原理的双抗已经在前期的文章中有过较为详细的介绍,简单来说,双抗主要依靠CD3抗体与T细胞表面的TCR-CD3复合物结合,避免了MHC分子抗原呈递的过程,大大缩短了传导路径,起到了直接活化T细胞杀伤肿瘤细胞的作用。
如今,众多药企正在用双抗去攻克的适应症为小细胞肺癌(SCLC),它的靶点为DLL3/CD3。这个赛道游的最快的双抗是安进的Tarlatamab,目前已经被FDA加速批准上市。
这还不够,深耕该靶点药企在双抗的基础上,迭代出了三抗。例如此前的一款早期药物HPN328,它在CD3和DLL3两个靶点的基础上新增了一个白蛋白的结合位点,用于延长药物的半衰期。这款药物这个名字或许并不是那么声名远扬,但它另一个名字已经在这几天传遍医药朋友圈:默沙东的MK-6070。
而这也成为了自单抗+ADC之后,研发界前沿们探索的重点:把双抗和ADC联用是否能有更好的效果?IO+ADC联用迭代的故事,又一次走入了新的时代。
03 路在越走越宽
多抗+ADC这个故事的起点或许准确来说并不是最近的BD。如很多类似的故事一样,它首先在血液瘤上打开了*扇窗,让大家看到了山那头的风光。
罗氏首先在血液瘤领域开辟了新大陆,过去罗氏在CD20单抗利妥昔单抗上取得了商业化的巨大成功。利妥昔单抗上市距今已经有27年的光景,2016年它的销售额达到了85.8亿美元,在血液瘤领域不断拓展适应症,一棵管线的树开出了多种适应症的花。
Lunsumio由罗氏开发,靶向CD3和CD20两个靶点,CD3自然是如上文所说,为了和T细胞上的受体特异性结合从而将其激活,免去MHC分子呈递抗原的过程。CD20则是由于其在B细胞上的高表达,使得其成为各类血液,淋巴类疾病的常青树靶点。其由Lunsumio已于2022年6月上旬获批上市。
ADC方面,罗氏上市了*款靶向HER2的ADC药物Kadcyla,在当时是ADC从一代到二代的重要迭代,适应症为乳腺癌。而血液瘤方面,罗氏则打造了一款更符合它未来战略布局的ADC药物:靶向CD97b的血液瘤ADC药物Polivy。其从获批开始,就被用于联合利妥昔单抗治疗复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)的成年患者。论联用,它经验丰富。
而它的想象力,如今也被罗氏带到了下一个平台:联用Lunsumio。
NCT03671018是目前罗氏正在做的一项1b/2期多臂临床试验,真正在将Lunsumio和Polivy的二者联用变成现实。本次临床适应症为治疗R/R NHL(复发性/难治性非霍金奇淋巴瘤)。患者在接受联合疗法前平均接受过2线治疗。
首先值得关注的是药代动力学和药效相互影响的问题,而事实证明这并不是问题。根据抗体密码的梳理:临床结果上,药代动力学方面,二者联合用药对双抗的代谢没有影响,其趋势和双抗单独用药类似。药效方面,二者联合用药不会影响双抗对T细胞的激活,此外,安全性上,二者联合用药并没有带来相互作用的负面效应,让1+1<2。
最为关注的疗效方面,此前单药的小样本临床中,二者单独用药的CR(完全缓解率)分别为24%和13%,而两者联合的CR为45.9%。本次如果将剂量爬坡组和扩展组合并,那么总体ORR达到了62.4%,CR达到了50.4%。
而临床安全性目前看来也无太大问题,有38.3%的患者发生了3/4级治疗相关的不良反应,最常见的为中性粒细胞减少和疲劳,而Lunsumio单药二线治疗R/R FL作为对比,与药物相关的3/4级不良反应达到了51%。CRS方面,CRS总的副作用为16.7%;Lunsumio二线治疗R/R FL上,当时,CRS达到了44%。当然,单药的II期临床是3年的随访结果,样本时间长度上数据更扎实。
该疗法在血液瘤领域,已经把这扇窗打开。而之后,先驱者们已经在尝试打开实体瘤领域的门。免疫疗法打造过K药的默沙东和ADC疗法当前版本的先驱者*三共,已经开始合作。
首先不可否认的是,*三共的DxdADC系列自身有着非常优越的性能。以DS-7300治疗小细胞肺癌适应症为例:在最开始的小样本21例重度经治SCLC患者的早期临床中,最后总体ORR达到了52.4%,mPFS为5.6个月,mOS为12.2 个月。今年1月,该药已经进入了III期临床阶段。
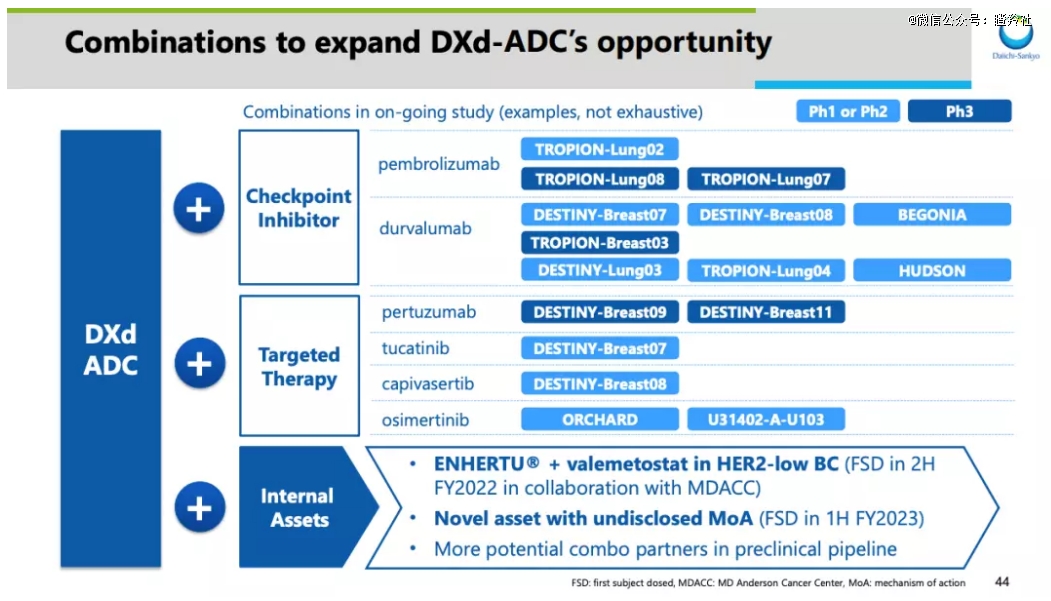
而作为ADC领域的先驱,*三共在探索ADC联用其它疗法的道路从未停止,根据*三共去年研发日给出的PPT,其目前寻求的联合疗法包括了现有的单抗等疗法。
另一方面,MK-6070则已经在小细胞肺癌领域也已经取得了不错的成绩。2023年10月公布的HPN328单药治疗SCLC和其他神经内分泌肿瘤的最新中期数据数据显示:在使用1 mg起始剂量治疗的所有肿瘤类型和患者组别中,经确认的ORR为35%(11/31),其中包括3例确认的完全缓解(CR)。SCLC患者的经确认的缓解率为32%(6/19)。
如今看来,或许双抗在单独使用的免疫疗法时不如ADC的单独治疗,但这么对比则显得并不客观,因为二者是完全不同的两种疗法,一种是通过细胞毒素杀伤癌细胞,另一种是通过激活免疫细胞,令T细胞去杀伤肿瘤细胞。
二者在很多时候,尤其是在未来绝大多数时候,都是联用的合作关系,而不是竞争去对比单药疗效的关系。研发和投资者更应该关注的应该是ADC与ADC之间的比较,抗体与抗体之间的比较,以及二者联用时会不会发生相互作用,产生的效果究竟是1+1>2,还是1+1<2。而目前从血液瘤结果来看,产生的联合效应非常可观,ADC先驱*三共会开启怎样的联用时代,非常值得期待。
同血液瘤类似,未来的结果上,首先应该关注临床前的药物代谢,药物相互作用和药物效果联用带来的效益。
04 国内的BD机会
如果默沙东的MK-6070三抗能够BD,那么更具性价比的国内资产,是不是也有共同合作的机会,亦或是被MNC相中,产生另一笔大额交易?
在未来那个新的联用时代里,自然少不了国内biotech/biopharma的缺席。
而在国内优质的多抗资产中,首当其冲的便是泽璟制药的ZG-006。ZG-006是DLL3和CD3另一种三抗的形式,它有两个抗DLL3臂,可结合两个不同的DLL3表位,这种设计可以大大增强该抗体对抗原的结合作用,此外,该结构还有可能具有克服DLL3治疗耐药的能力。
临床前研究结果显示,ZG006在小鼠肿瘤模型上具有显著的肿瘤抑制作用,可以导致显著比例的小鼠肿瘤完全消退,该药于2023年7月开展了临床试验。
而在小细胞肺癌的ADC方面,国内也有着较为优质的资产,例如近期再鼎生物从宜联生物引入的ZL-1310。该药直接靶向SCLC的核心靶点DLL3。该药目前的临床前试验数据较为出色;在利用SCLC细胞系衍生的异种移植模型(CDX)中,ZL-1310对肿瘤生长的抑制呈现了显著的剂量依赖性。在高剂量组中,肿瘤体积显著缩小,部分模型甚至达到了完全缓解状态。
之所以如此关注小细胞肺癌适应症的ADC和双抗,自然是因为它是众多药企发展双抗的重要切入点。但未来更需要关注的,是双抗在实体瘤领域的拓展;毕竟对于ADC药物来说,SCLC不能说是个非常“好”的适应症,它的经典靶点DLL3普适性并不强,只能靶向神经内分泌瘤这个种类,此外,SCLC的市场并不算大,仅占整体肺癌市场的10%-15%左右。
因此,笔者认为在关注下一代联用时,首先找到更加普适性,在不同癌症上表达更广泛的双抗靶点,是一个很大的突破点。
这并不是没有,例如信达现在的claudin18.2/CD3双抗IBI-389已经进展较快。更为可贵的是,它本身就有claudin18.2 ADC药物。或许,创新药二哥会是*个在国内走通这个联用模式的药企。
claudin18.2作为消化道肿瘤的靶点,在适应症人数上市场远比SCLC更大。而IBI-389更是现在同靶点进展最快的双抗。它的临床I期数据已经今年ASCO大会上公布。
患者基线上,72例晚期不可手术或转移性胰腺导管腺癌接受治疗,所有受试者既往均接受至少1线治疗,其中55.6%的受试者既往接受过2线及以上系统治疗。
在RP2D推荐剂量600μg/kg组中,共评估了27例患者疗效,确认的客观缓解率(cORR)为25.9%,疾病控制率(DCR)达到了70.4%。
而信达的claudin18.2 ADC——IBI-343则早已经声名远扬。在其今年7月最新汇报的数据上,在6mg/kg剂量组中(N=30),客观缓解率(ORR)及疾病控制率(DCR)分别为36.7%和93.3%;在8mg/kg 剂量组中(N=17),ORR达47.1%,DCR为88.2%。
未来的想象力,大概在双抗靶点组合的持续拓展上,当然,康方类型的双抗/多抗与ADC的联用也是一个主流方向。笔者将会在之后进行梳理。
结语:这既是一部迭代史,也是国内外药企们的疗法马拉松。单抗和ADC联用目前商业化初现迅猛势头,先驱们已经在布局双抗。马拉松终点——癌症治愈或许远未到来,但一步步的迈进,远比待在原地更加幸福。
【本文由投资界合作伙伴微信公众号:瞪羚社授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






