近年来,真实世界研究一再证明自己的价值。
无论是进行药品、医疗器械上市后的相关评价,还是在特定条件下,作为药品、医疗器械申报上市提供相关证据,真实世界研究吸引了大量*的科研团队和开发企业。从过去几年所取得的成绩看,真实世界研究的应用优化了药品、医疗器械的审批流程,也为大量临床问题提供了解答。
那么,国内的真实世界研究应用,走到哪一步了?对于企业而言,布局真实世界研究是否就能稳赚不赔?我们试着讨论这些问题。
真实世界研究形成闭环
单从概念看,真实世界研究是十分理想的试验策略。避免了刻意的临床试验设计,可能提供比随机对照试验提供更客观、丰富的数据,直接跟踪患者治疗情况,伦理层面也似乎更可行。但真实世界研究的应用探索真正热起来,是在近几年,尤其是当真实世界证据可用于产品注册之后。
在国内,早期的的真实世界研究,主要被用来验证与中医药相关的临床问题。
据Pubscholar记载,在2010年,来自中国中医科学院中医临床基础医学研究所的田峰和谢雁鸣两位研究者,连发2篇文章,论述了真实世界研究在中药上市后再评价中的价值。研究表明,在保证人民群众用药安全、有效的前提下,基于RWS的中药上市后临床再评价研究可能延长药品的市场生命。
尽管只是纯粹的理论研究,却为国内真实世界研究奠定了逻辑基础。随后,关于灯盏细辛注射液、松龄血脉康胶囊、腹针、疏血通注射液等临床上常见的中医药手段的真实世界研究陆续开展起来。
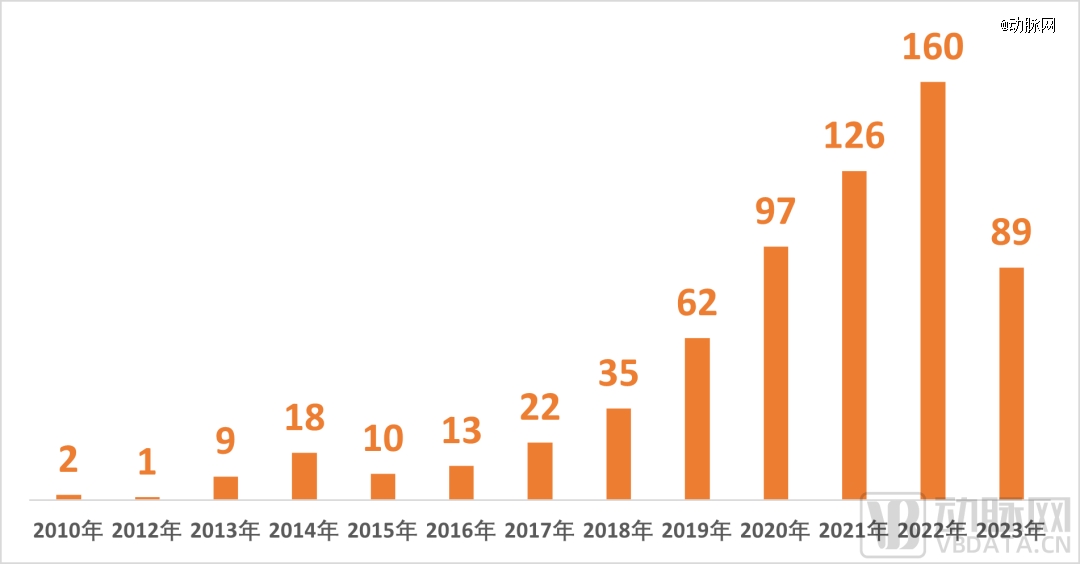
国内真实世界研究相关成果数量
数据来源:Pubscholar
在很长一段时间里,国内真实世界研究的热度并不高。变化出现在2017年以后,越来越多创新的生物制剂,借助上市后的真实世界研究,来丰富临床证据。根据Pubscholar数据,国内主流的高校和医疗机构,纷纷布局真实世界研究。其中,中国中医科学院中医临床基础研究所的真实世界研究成果最丰富,达到11项。不过,纯粹为上市后研究提供证据,真实世界研究对医药企业的吸引力有限,他们更加关注的,是产品注册审批。

部分开展真实世界研究较多的高校
数据来源:Pubscholar
实际上,在国际上,利用真实世界研究来加速创新产品审批,已经有近半个世纪的历史。
早在20世纪70年代,海外药物监管部门就尝试使用真实世界证据,来批准罕见疾病的新治疗方案。2016年12月,美国食品药品监督局FDA通过的《21世纪治愈法案》,真实世界研究走上了更大舞台。在美国,真实世界证据,可以取代传统临床试验,进行扩大适应证的批准。
此后,真实世界证据在全球药品、医疗器械注册申报中的应用生态越来越成熟。2017年8月开始的3年内,美国密集发布了大量真实世界证据的监管规则,包括《采用真实世界证据支持医疗器械的法规决策》、《临床研究中使用电子健康档案数据指南》、《真实世界证据方案框架》、《使用真实世界数据和真实世界证据向FDA递交药物和生物制品资料》等,来进一步完善与真实世界研究相关的监管规则体系。在这个过程中,欧盟药品管理局、日本药品和医疗器械管理局,也在多个层面体现对真实世界研究用于药品研发和监管决策的关注和重视。
国内的真实世界研究审批创新药和医疗器械实践,始于海南乐城的医疗先行区试点。
2019年6月,国家药监局与海南省政府联合启动海南临床真实世界数据应用试点工作,尝试将临床真实世界数据用于医疗器械产品注册。同年9月,国家四部委联合发文支持博鳌乐城先行区发展,并明确提出“开展真实世界临床数据应用研究”。随后,将真实世界研究应用于药品、医疗器械审批的相关规定体系,陆续建立起来。

国内部分真实世界研究相关政策
数据来源:动脉网根据公开信息整理
2019 年10 月,首批“真实世界研究”试点产品遴选启动。但当时,国际药械企业参与积极性并不高,最终只有3个产品入选,其中就包括艾尔建的青光眼引流管。入选后,艾尔建很快开始通过在乐城医疗先行区的临床实践,采集真实世界数据。据了解,艾尔建的青光眼引流管用于微创房水内引流术,当时已经在国外上市。
彼时,这款产品在国内还没有同类产品。青光眼是世界排名第二的致盲性眼部疾病,被称为“沉默的视力窃贼”,它所引发的视功能损伤,不可逆。艾尔建的青光眼引流管植入术步骤简单,安全可控,无需破坏结膜及巩膜组织,仅需透明角膜缺口即可轻松植入,有效避免了术中出血以及其他并发症,显著降低了手术风险。
2020年3月,艾尔建的青光眼引流管正式获批在国内上市,成为国内*使用境内真实世界数据获批上市的医疗器械。而这距离对应的真实世界研究启动,还不到5个月。此前,在传统申报方式之下,拟进口产品需要经过严格的临床试验,往往至少耗时3至5年。
艾尔建青光眼引流管上市的2个月后,乐城医疗先行区的第二批“真实世界研究”试点产品申报启动。青光眼引流快的急速获批,瞬间点燃了国际药械巨头的热情,共有47个进口医疗器械品种申报进入第二批试点。
2022年6月,欧康维视生物开发的治疗慢性非感染性葡萄膜炎产品OT-401(氟轻松玻璃体植入剂),在国内获批上市,成为国内药品注册史上*个完全基于真实世界研究数据申报和获批上市的新药。2018年10月,OT-401获批在美国上市,用于治疗累及眼后段的慢性非感染性葡萄膜炎,是FDA在当时*批准的、可释放氟轻松长达36个月的用于治疗慢性非感染性葡萄膜炎的新药。
在国内,葡萄膜炎是第二大致盲性眼病,原有的解决方案难以帮助患者长时间稳定葡萄膜炎炎症,避免反复发作引发眼内组织损伤,用药依从性较差。欧康维视生物从OT-401的原研药厂EyePoint Pharmaceuticals手中,取得了这款产品在大中华地区的*开发和商业化权利。OT-401通过真实世界研究快速上市,无疑填补了国内慢性非感染性葡萄膜炎治疗领域的空白。
至此,真实世界证据在国内药品、医疗器械的注册审批、上市后评价等场景,都有了应用,闭环的生态正在形成。
巨头的抢跑
根据刚刚结束的第二届博鳌国际药械真实世界研究大会数据,过去 3 年间,在乐城医疗先行区的真实世界数据应用试点中,累计有13个试点品种获批上市,试点范围覆盖肿瘤、免疫、眼科等多个领域。2023年4月开始,乐城医疗先行区地医疗器械真实世界研究进入常态化,更多创新医疗器械品种申请纳入真研前置沟通渠道。

国内部分基于真实世界研究获批的产品
数据来源:动脉网根据公开信息整理
值得注意的是,真实世界研究已经成为跨国医药巨头进入国内市场的重要方式,除了已经基于真实世界证据,将创新的全球产品送到国内的医院中的艾尔建、强生、波士顿科学、诺华制药等企业外,辉瑞、默沙东、赛默飞等跨国医药企业也纷纷布局真实世界研究。
采用真实世界研究的路径,跨国企业往往能在药械上市后3年左右,让新产品进入国内市场,这对于斥重金做研发的跨国医药企业而言,至关重要。比如,艾尔建的青光眼引流管从美国上市到中国上市,间隔不到4年,强生的白力士、波士顿科学的蒸汽治疗设备,则间隔不到3年,诺华制药的英克司兰钠注射液,两地上市间隔时间更是缩短到2年以内。
更重要的是,抢跑进入国内市场的创新药械,由于填补了临床空白,市场渗透的速度通常相当快。比如,心血管领域的国际*小干扰核酸药物英克司兰钠注射液,2021年7月在乐城实现全国首例应用,仅一年多时间累计使用7000余例次。而2022年3月正式获批上市得波士顿科学的试点品种热蒸汽治疗设备和一次性使用前列腺热蒸汽治疗器械,已经在全国100余家医疗机构使用,累计治疗约1000名前列腺增生患者。
2023年8月,诺华制药的新型降胆固醇药物英克司兰钠注射液获国家药监局批准上市,这是乐城医疗先行区的临床真实世界数据应用试点中,获批上市的第4个药品。
英克司兰钠注射液主要用于成人原发性高胆固醇血症(杂合子型家族性和非家族性)或混合型血脂异常患者的治疗等。2021年8月,该产品进入博鳌乐城临床真实世界数据应用试点。从提交注册申请到获批上市,仅历时9个多月,极大缩短了该产品进入中国市场的时间。
2023年以来,更多的跨国医药企业抢滩真实世界研究。他们一方面以乐城先行区为据点,拓展真实世界研究的业务边界,另一方面则加强与国内医疗机构的真实世界研究合作。
2023年5月,赛诺菲与海南乐城真实世界研究院签订战略合作协议,双方将通过开展创新产品先行先试、真实世界研究、举办学术交流等,推动创新产品落地。此外,在第六届进博会上,辉瑞中国也海南乐城真实世界研究院、暨南大学粤港澳大湾区药品医疗器械真实世界研究院、华润广东医药有限公司签订战略合作协议,方将共同促进海外及香港上市的创新药物在海南博鳌乐城先行区、大湾区开展真实世界研究,推动创新药物审评加速。罗氏诊断中国、罗氏制药中国则携手上海交通大学医学院附属瑞金医院,共同发布淋巴瘤诊疗方案,协力推进 DLBCL 治疗的多中心临床的大型真实世界研究。
相比之下,默沙东的布局则更深。11月6日,默沙东(海南)创新医疗有限公司在进博会上揭牌,成为*进入海南省的跨国医药企业子公司。而在此之前,默沙东就一直在乐城医疗先行区从事真实世界研究。2020年7,默沙东中国与乐城管理局签署备忘录,双方在乐城先行开展真实世界研究等方面加深合作达成共识。2023年3,默沙东成为海南乐城真实世界研究院理事成员单位,积极共建海南乐城真实世界研究院,推动真实世界研究科创孵化工作。
Biotech弯道超车?
动脉网注意到,除了跨国医药企业外,国内的Biotech也从真实世界研究中获益。
2021年3月,基石药业开发的普拉替尼胶囊,基于真实世界研究证据,在国内获批上市,用于既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是国内获批的*RET抑制剂,也是基石药业在IPO两年后。迎来的*商业化产品。从基石药业最新的财报看,抢跑上市的普拉替尼胶囊,成为这家未盈利Biotech的主要收入来源。
普拉替尼上时候的*个完整年度,根据基石药业2022年年报,共实现收入4.81亿元,较上年几乎翻倍,普拉替尼作为三款商业化的产品之一,功不可没。而根据基石药业2023年半年报,2023年前6个月,共实现收入2.615亿元,相比2022年同期,增长53%。
同样通过真实世界研究上市的OT-401,也成为未盈利的欧康维视生物的主要收入来源。根据欧康维视生物 2022 年财报,在OT-401 上市当年,公司总收入从 5614.6 万元增长至 1.58亿元,增幅近3倍。欧康维视生物还表示,OT-401有望为 2023 年的销售业绩带来有力支撑。
不过,医药企业想要通过真实世界研究,推动产品快速上市,门槛并不低。从已经获批上市的13款产品来看,技术*、临床急需,是基本要求。而在具体的审批实践中,对于可以参与真实世界研究,并基于真实世界证据申报产品注册,门槛并不低。
具体而言,一方面,基于真实世界证据申报注册的产品,通常具备了相当充足的海外临床研究数据,而真实世界数据仅用作辅助证据。比如,在乐城医疗先行区开展真实世界研究前,欧康维视生物的OT-401在境外已经完成的三期临床试验数据,普拉替尼申请上市提交的主要数据也来自海外,乐城医疗先行区的真实世界数据则为普拉替尼在中国晚期非小细胞肺癌人群中的疗效评价和安全性评估提供了辅助。
另一方面,现阶段,对于大多数药物、医疗器械和疾病而言,真实世界研究的试验设计还没有标准化的方案,这就需要真实世界研究的开办者具有丰富的临床实验和数据分析经验,否则将很难成功,毕竟利用真实世界数据向国家药监局申请上市的前提,是数据要达到主要终点指标,体现出统计学的差异。
动脉网查询公开信息发现,欧康维视生物提交给国家药监局的 OT-40申报资料,是真实世界数据研究中的28例受试者数据,而基石药业授权引进的普拉替尼也使用了乐城9例受试者的真实世界数据申报上市。此前有媒体分析,真实世界研究的方案设计,既要考虑产品本身的临床价值,也要考虑涉及的国内人群特点,难度非常大。
不可否认,将真实世界研究作为创新医药产品上市申报的辅助工具,减轻了药企和医疗器械企业的研发压力,也拉进了患者与*进疗法之间的距离。但医疗毕竟是非常严肃的工作,真实世界数据如果要发挥更重要的价值,无疑还需要更严厉的监管,和更充足的临床证据。
【本文由投资界合作伙伴动脉网授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






