说到代谢疾病,首先想到的就是糖尿病,围绕糖尿病,药企、械企、投资机构倾注了大量资源,从药品如GLP-1到器械如CGM以及各类针对糖尿病管理的数字疗法在此热潮下应运而生。诚然,作为全球*大代谢疾病,糖尿病值得如此投入,但身为第二大代谢疾病的高尿酸血症及痛风,已经10年没有新药了。
据弗若斯特沙利文数据显示,2020年全球高尿酸血症和痛风患病人数合计超过11亿,中国患者也已经超过2亿,预计将在2024年分别达到11.3亿和2.6亿人口。高尿酸血症和痛风大有加入“三高”成为“四高”的趋势。
随着全球患者规模的不断增长,对应药物的市场规模也将持续增大。目前,痛风无法完全治愈,在急性发作期后,需要长期依靠药物来抑制尿酸生成或促进尿酸排泄达到降低患者血尿酸的目的。然而,这个数亿患者的治疗需求却远未被满足。
安全,痛风药的阿喀琉斯之踵
国内最新一款痛风药非布司他获批上市的时间,已经是10年前的2013年,且目前已经上市的几款痛风药几乎都存在副作用及疗效欠佳的问题。
据《中国高尿酸血症与痛风诊疗指南》,目前对于复发性急性/慢性痛风的一线治疗药物为黄嘌呤氧化酶抑制剂(XOI)和尿酸盐转运蛋白1抑制剂(URAT1)。前者的代表是别嘌醇、非布司他和托匹司他,后者的代表是丙磺舒、苯溴马隆、雷西纳德和多替诺雷。
XOI类药物一直以来存在疗效不佳的问题,约有40%~60%的患者在服药后无法有效控制尿酸水平且存在安全性问题。早在2017年,FDA就已发布过关于非布司他的安全性警示信息,之后在2019年,FDA又要求在药品说明书中加黑框警告,有增加心血管死亡风险,存在痛风发作、肝毒性和严重皮肤过敏的风险。
URAT1类药物的副作用也为人诟病。如丙磺舒会增加肾结石和肾脏疾病的风险;赛诺菲的苯溴马隆有较严重的肝脏毒性,甚至有死亡的案例发生。因此,该药2003年从赛诺菲所在的法国退市,随后在德国之外的大部分欧洲国家退市,FDA更是自始至终都没批准苯溴马隆在美国上市。雷西纳德虽然在2015年获FDA批准,但也因为肾毒性于2019年被撤销上市。

已上市痛风药物,数据源于公开信息、广发证券发展研究中心
国内市场,目前以非布司他、别嘌醇和苯溴马隆为痛风患者的主要用药,而最新获批的非布司他,已经是10年前的事情。放眼全球市场,除了多替诺雷于2020年获批上市以外,无论是XOI类药物还是URAT1类药物都已多年未曾出现新品了。即使是多替诺雷,目前也仅在日本市场上市,声量有限,且安全性方面仍需进一步研究观察。
除了以上两类常用药物外,还有一类尿酸氧化酶药物,它通过分解尿酸从而降低血尿酸水平,但该类药物在使用中容易产生抗体,对高尿酸血症的治疗作用有限,并且这个品类目前还没有产品在国内获批上市。
近20年来,随着生活水平的提高,人类饮食结构的改变,高嘌呤食物的过量摄入以及生活习惯的混乱导致高尿酸血症和痛风的发病率不断增加,现有药物各有各的疗效和安全性问题,高尿酸血症痛风人群亟待疗效和安全性都有保障的痛风药出现。
尽管市场规模不如糖尿病大,但数亿患者长期未被满足的临床需求,也将造就一个新的蓝海市场。谁能在安全性及有效性上做出突破,必将受到市场追捧。
突破,ACR年会上两款新药结果重磅亮相
在11月10日召开的2023年美国风湿学会年会(ACR)上,一品红参股的Arthrosi Therapeutics公司公布了痛风治疗药物最新的研究进展,让这个多年未曾出现波澜的水面上掀起一丝涟漪。
尽管现在ACR痛风治疗指南中,对于痛风患者的目标血清尿酸(SU)为<6mg/dL,并需维持3个月~6个月才能有效预防痛风再次发作。可一直以来对于SU数值存在争议。此次ACR大会公布的最新研究表明,SU水平或应<3.9mg/dL,才是*的痛风治疗血尿酸水平。
这项数据分析汇集了约6183名研究对象,中位年龄65岁,中位SU为8.6mg/dL。参与者被随机分配接受非布司他或别嘌醇治疗,其中71%的患者在3个月时SU<6mg/dL,随着时间的推移,这一比例还有所增加。在SU≥10mg/dL的组别中,痛风发作率始终最高,且二次复发的时间最短仅相隔3个月。
在开始治疗的一年内,除开SU≥10mg/dL的组别,其余组别并无显著差异,但将时间范围聚焦到12个月~72个月之间时,即便是SU在4.0mg/dL~5.9mg/dL的组别和SU≤3.9mg/dL相比,发作率也显著上升。
也就是说,要想达到长期治疗效果,SU或要达到≤3.9mg/dL的水平,这也对痛风药物提出了更高的要求。
虽然现有的URAT1类药物存在很多问题,但目前有90%的高尿酸血症都是由肾脏尿酸排出缺陷造成的,而URAT1 抑制剂可以通过抑制尿酸盐的重吸收,从而促进尿酸从体内的排泄并降低血尿酸水平。
因此,URAT1的价值依然不可小觑,即便苯溴马隆、雷西纳德这些前辈的身世坎坷,后来者依然选择URAT1这条路,只是将研发的突破点放在如何保证安全性。
ACR大会上公布了一项基于URAT1抑制剂AR882的研究,旨在评估AR882与安慰剂相比在痛风患者中的安全性和疗效。
这是一项全球性、多中心、随机、双盲、12周、安慰剂对照的2b期临床试验,招募了140例18~75岁,估算肾小球滤过率(eGFR)>30ml/min/1.73㎡且平均基线SU水平为8.6(±1.3)mg/dL的痛风患者,并以1∶1∶1的比例随机分配到AR882 50mg、75mg和安慰剂三个小组之中。每2周采集1次血样,随访12周,以监测SU水平和治疗安全性。
参与研究的患者还伴有常见的合并症如高血压、高脂血、慢性肾脏病以及关节炎、糖尿病和心血管疾病。最后结果显示,在意向治疗人群中,75mg组别中分别有82%和73%患者的SU<6mg/dL和<5mg/dL;在50mg组中这个比例则为71%和45%。而在符合治疗方案人群中,75mg组数据变为89%和82%,50mg组变为78%和50%。
此外,eGFR在60~89mL/min/1.73㎡的患者与eGFR>90ml/min/1.73㎡的患者有相似的治疗应答率,并且显著高于eGFR<60ml/min/1.73㎡的患者。更重要的是,治疗组患者未发生严重不良事件,痛风发作发生率约30%,与安慰剂组比例相似。研究中的轻、中度不良反应,有腹泻、头痛、上呼吸道感染等,均未导致试验停药。
在为期12周的研究中,相比于既往药品,AR882在安全及有效方面表现良好,打破了URAT1不安全的桎梏。
除了URAT1,ACR上也公布了尿酸氧化酶药物最新的研究进展。
对于难治性痛风患者,即便经过规律治疗后SU依然很难保持在<6mg/dL的水平,并且还将产生一系列的严重症状。目前,基于尿酸酶的新型疗法对于此类患者有效,但也存在抗药抗体形成的问题。SEL-212由雷帕霉素(SEL-110)与聚乙二醇化尿酸酶(强免疫原性酶,SEL-037)共同给药组成,具备减轻抗药物抗体形成的潜力,方便每月给药一次,提高尿酸酶的疗效和耐受性。
ACR大会上公布的研究评估了SEL-212治疗成人难治性痛风的安全性和有效性。
这项研究为安慰剂对照、双盲、随机临床试验。D1美国组入组112例(96%为男性,66%≥50岁),D2全球组入组153例(97%为男性,72%≥50岁)。入组标准为18个月内痛风发作次数≥3,或有1个及以上痛风石,或当前诊断为痛风性关节炎且未使用任何黄嘌呤氧化酶抑制剂让SU恢复正常,同时既往未接受过聚乙二醇化尿酸酶治疗。
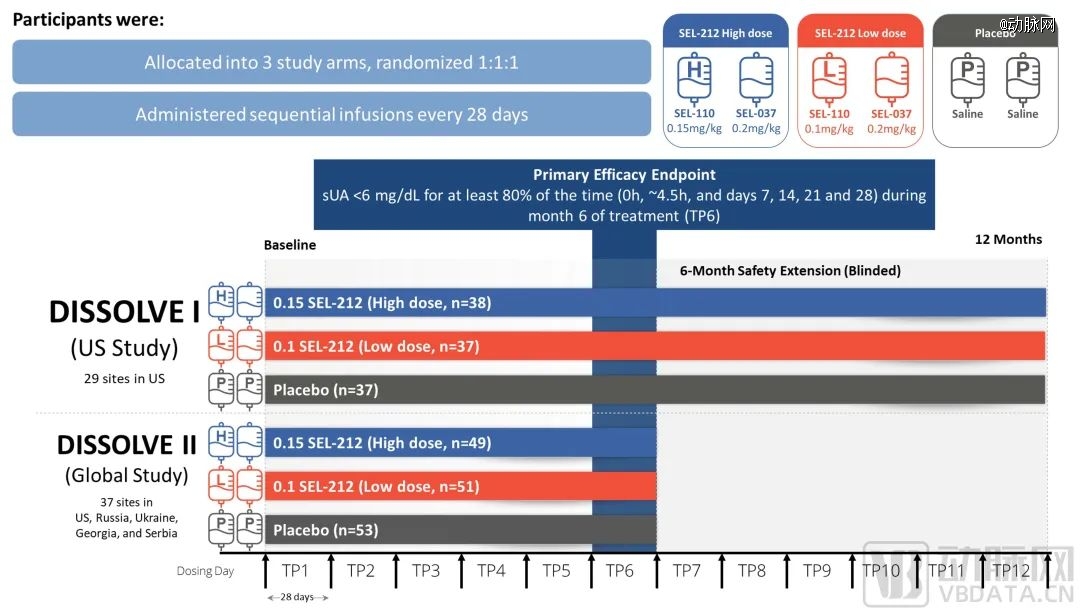
SEL-212研究设计,图源ACR
结果显示所有治疗组的应答率均显著高于安慰剂组(p≤0.0008),美国组和全球组的高剂量组应答率分别为56%和46%,低剂量组应答率分别为48%和40%。在50岁以上的高龄患者中,两个组别的高剂量组应答率分别为65%和47%,低剂量组分别为47%和44%(与安慰剂相比p≤0.0026)。值得注意的是,高剂量组和低剂量组分别有3.4%和4.5%的患者发生输液反应,比例与安慰剂组相当。
与安慰剂组相比,每月1次的SEL-212治疗显示出统计学差异的缓解率和血清尿酸降低,同时在安全性方面有所保证,未来或将为难治性痛风患者在XOI和URAT1之外提供一种新的解决方案。
一直以来,安全性问题都是悬于痛风药头上的达摩克利斯之剑。ACR上发布的研究表明,或许药企已经迈出了最为关键的一步。
竞争,国内药企先后布局
面对巨大的市场需求,国内药企自然不会缺席,包括恒瑞、一品红、益方生物等多家国内企业都有所布局。
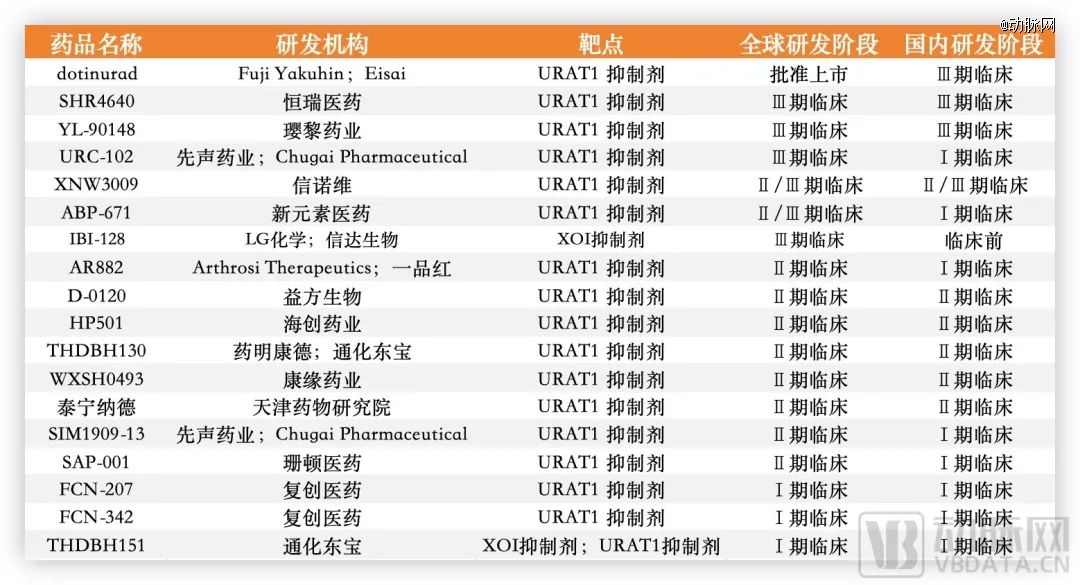
国内部分痛风药研发进度,数据源于公开信息、CDE
虽然早在上世纪70年代,URAT1抑制剂就踏上了历史舞台,但安全问题却一直笼罩着这个明星靶点。随着阿斯利康的雷西纳德在2015年获FDA批准,国内有超过10家企业跟随,然而随后的研究表明安全问题仍然未被解决,单药治疗均存在肾毒性,之后研发开始转向药物联合治疗。
恒瑞医药的SHR4640就是走的这条路线。SHR4640已获批开展多项临床研究,其单药用于治疗原发性痛风伴高尿酸血症患者的临床试验早在2019年就已进行到III期,临床结果却并未披露,而后又于2022年开始联用非布司他进行Ⅱ期临床。
一方面,雷西纳德路线的跟随者面临着挑战,另一方面苯溴马隆却迎来转机。经研究发现,苯溴马隆肝毒性成因是因为苯并呋喃环相邻碳上的芳基氧化产生的对苯醌导致,如能避免对苯醌的产生则有望解决安全问题。
2019年,日本企业Fuji Yakuhin研发的多替诺雷公布了临床数据,多替诺雷在苯溴马隆的基础上改造了苯环相邻环结构,降低了肝毒性。临床数据显示,以0.5mg为起始剂量给药两周后,患者SU水平明显降低;10周后,维持2mg剂量,SU水平低于6mg/dL的患者为80%~90%;到研究终点34周或58周后,90%的患者SU水平下降至6mg/dL以下。整体疗效与苯溴马隆相当,且未出现严重不良反应。
2020年,卫材收购了多替诺雷再中国市场的*开发销售权益,目前已处于3期临床阶段。新药的表现让URAT1再次成为热点,国内跟随者们再次跟进。
信诺维的XNW3009选择了多替诺雷的路线,以低剂量即可实现降尿酸效果,目前已经完成临床II期研究,即将进入III期临床。II期临床数据显示,0.5mg剂量组每次给药即可实现超过72%的受试者血清尿酸浓度≤360umol/L,对照组苯溴马隆50mg剂量组的有51.9%的受试者血清尿酸浓度≤360umol/L。
整体来看,XNW3009的临床数据与多替诺雷效果相似,0.5mg剂量组降血清尿酸效果明显高于苯溴马隆50mg剂量组,且安全耐受性良好,未见明显的肝、肾毒副作用,同时在临床药理学方面也展现了良好的药代和药效动力学特征。
此外,一品红参股公司Arthrosi已经就创新药AR882与FDA进行的EOP2会议沟通完毕。FDA书面反馈支持Arthrosi在研药物AR882按计划推进全球Ⅲ期临床试验。在ACR年会上公布的其全球IIb期临床结果中,展现出良好的有效性和安全性,并且克服了既往药物肝肾毒性高的缺点,有望实现差异化竞争。除了前述临床最新突破性成果,一品红表示还将在后续会议中展示更多药代动力学和药效学数据。
除了URAT1抑制剂外,信达生物还于2022年底斥资6.6亿元向LG化学引进了Tigulixostat(IBI-128),这是一款基于黄嘌呤氧化酶抑制剂(XOI)开发的药物,在临床2期研究中展现出良好的降血尿酸水平作用和安全性,与安慰剂组及非布司他相比,Tigulixostat在治疗第3个月所有剂量组均达到血尿酸水平小于5mg/dL的主要终点。LG化学已于2022年底启动Tigulixostat国际多中心3期临床试验。
不难看出,国内药企痛风药产品关系的布局非常丰富,不少药物已达临床后期阶段,预计未来几年将有多款新药获批。但从另一个角度来看,目前国内药企的布局还是以跟随为主,多替诺雷虽尚未出现安全性问题,可一旦出现又将产生SHR4640这样研发进度放缓的问题。国内数亿痛风患者亟待安全且有效的新药出现,谁能真正满足他们的需求,谁才能真正开启这片蓝海市场。
【本文由投资界合作伙伴动脉网授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






