2023年,默沙东的K药如愿登顶“全球药王”之位,但其注定不会像上一位“药王”修美乐一样长期称霸(连续蝉联11年)。
无疑,GLP-1药物正在对K药的药王宝座发起强烈冲击,市场投资者预计在两年内实现更替。
K药全球销售额在2019年突破百亿美元大关,2022年突破两百亿美元门槛,用时三年;而司美格鲁肽销售额从2022年109亿美元到2023年的212亿美元,仅仅使用了一年的时间。
目前,PD-1在单药大适应症上的潜力已经挖掘的七七八八,需要通过组合疗法来激发出全新的增长引擎;而对于GLP-1类药物而言,目前其在代谢领域的单药潜力并非是“完全体”(当前销售额仅占展现部分降糖、减重市场潜力),NASH、心血管、阿尔茨海默症等其他大适应症市场开发仍在路上。
GLP-1领域的*之姿,也让礼来和诺和诺德登上了全球前二大市值药企,两者市值分别为7189.2亿美元、5493.95亿美元。
更可怕的地方在于,“礼诺”正在不断的迭代和丰富自己的GLP-1布局,举措不仅包括广开新适应症、开发双&三靶点更强效果的分子、开发不同剂型的GLP-1药物及BD组合疗法伙伴。
在投资者对于GLP-1资产市值上限和空间踌躇之时,新的减重伴生投资机会又在哪里?
近半年来,礼来通过以19.25亿美元收购Versanis、投资BioAge Labs并计划联用其核心产品开展二期临床这两个动作,揭示了“全球药企一哥”全新的代谢领域下注方向:降脂增肌。
01
循环减重危害引发的全新需求
众所周知,GLP-1减重药*的软肋是“停药反弹”和“需长期服药”。
礼来赞助的美国多所大学关于GLP-1药物停药后是否会反弹的研究显示:在670名接受36周替尔泊肽治疗的患者,治疗后平均减重20%。随后,试验将部分患者分配至安慰剂组观察随访1年,分为继续治疗和安慰剂组两个队列,最终停药一年的患者体重增加了初始体重的14%,继续给药的患者在巩固36周减掉体重的同时继续减掉了平均5.5%的体重。
诺和诺德的司美格鲁肽同样进行了与替尔泊肽类似的研究,结果与其相似,不过司美格鲁肽的“反弹”更为凶猛,停药患者体重恢复了此前减重体量2/3。
这种性状,实际上对于利用GLP-1药物“循环减重”或者“间歇性用药”的患者人群十分不友好。
再生元首席科学官George Yancopoulos博士指出:现有的GLP-1减肥药并非*无缺,在减重过程中患者除了失去脂肪,还将失去肌肉(占体重减轻的40%)。
对于GLP-1药物停药反弹想再次减重的患者来说,减重时他除了失去脂肪还失去了肌肉,而体重反弹时他们恢复的只是脂肪;长此以往,“循环减肥”将渐进的改变这类人群的身体构成,身体的脂肪含量会越来越高,肌肉将越来越少。
正因GLP-1类药物存在这类局限性,如何更高质量的减肥成了时下的热门研发领域。
那么,肌肉流失的危害有多大?
肌肉组织不仅支撑人类个体的日常运动,还起到帮助人体吸收营养物质并代谢掉体内的废物等功能。
肌肉流失除了带来日常活动及体运动能力的下降,还会来带代谢改变、骨质疏松风险增加和免疫功能下降等危害。
上述危害可能代表增加各类疾病的患病的风险,仅以肌肉的承重能力对应潜在疾病而言,当肌肉流失严重时,可能会发生如子宫脱垂、直肠脱垂等疾病,若流失的是心脏肌肉,还可能出现心肺功能减弱、心肺衰竭等危急情况。
02
百花齐放趋势的增肌减脂靶点
降脂增肌作为新一代减肥药物或伴侣的研发方向,全球在研的靶点并不在少数,包括肌肉生长抑制素、雄激素受体调节剂、代谢调控加速器等,本文重点聚焦礼来系已经重点下注肌肉生长抑制素和艾帕素领域(ActRII受体和apelin受体靶点)。
肌肉生长抑制素(MSTN)是一种限制骨骼肌然蛋白质(ActRII是MSTN主要受体),部分研究表明:其较高活性能够抑制骨骼肌的增长(研究表明敲除MSTN基因的小鼠肌肉质量增加25-30%),过去一直是神经肌肉疾病中治疗脊髓性肌萎缩症(SMA)的重要研究方向。
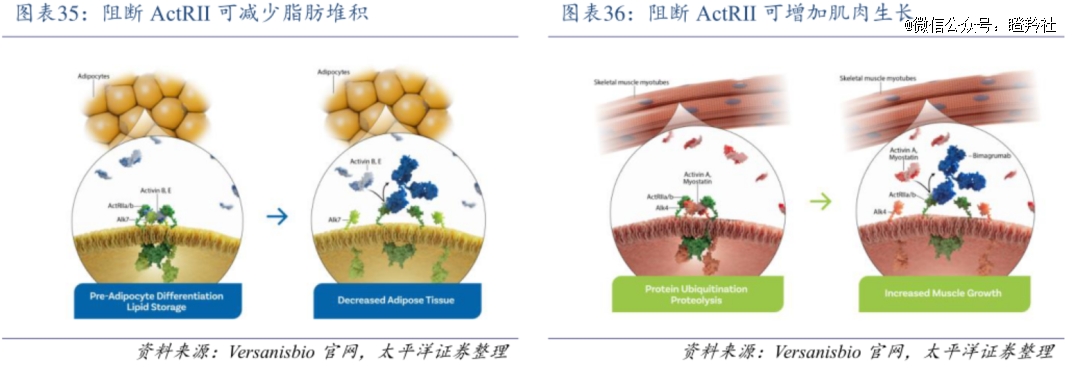
近年来,MSTN抑制剂的研发正好与目前减重药物的缺陷形成“互补”的曙光。一方面,MSTN抑制剂可能影响代谢过程,有助于调节能量平衡和代谢;另一方面,MSTN抑制剂对增加肌肉质量可能有帮助,可增加能量消耗进而有助于减少人体脂肪,达到此消彼长的目的。
艾帕素(Apelin)是一种因运动而释放分泌的多肽,它通过与骨骼肌、心脏、和中枢神经系统的相互作用调节新陈代谢,调节新陈代谢并促进肌肉再生。
BioAge的研究显示,人的一生中,总体Apelin水平会逐渐下降,而Apelin水平较高的人具有更强的身体功能和更长的寿命。
从全球相关靶点研发进度看,MSTN抑制剂有较多临床在研产品,但核心适应症以肌肉萎缩相关适应症为主;而Apelin受体激动剂全球进入临床阶段的分子较少,BioAge的Azelapra进度*。
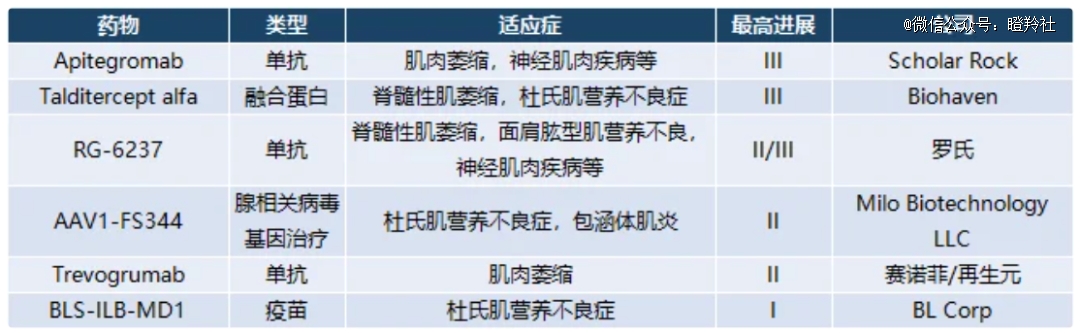
(靶向肌肉生长抑制素疗法不完全统计 图源:吉满生物)
礼来收购的Versanis靶向ActRII受体抑制剂Bimagrumab已经收获了非常积极的数据。
据Versanis早前公布的48周二期临床针对2型糖尿病的超重或肥胖患者数据显示,相比安慰剂,尽管Bimagrumab治疗组的体重虽只下降了6.5%,造成患者约22%脂肪含量的丢失,并且增加4.5%的无脂体重。更重要的是,相比一般的GLP-1药物,Bimagrumab治疗组患者停止治疗12周内并未观察到体重的增加。
而另一边礼来投资的BioAge,在一项227名65岁及以上的老年人的早期临床试验表明:Apelin受体激动剂Azelaprag可预防老年人的肌肉萎缩。
从Bimagrumab到Azelaprag两款产品布局,我们可以看到礼来迭代、揽全的多点出击思维,但前者为单抗,后者为小分子,也考虑到了未来患者的依从性需求。
03
国产分子的机会
相对于火热的减重,降脂增肌这样新兴而差异化的领域在国内显得更加的“先进而有价值”。
目前从全球来看,ActRII和apelin两个靶点的竞争格局十分良好,尽管前者在研相关药物较多,但适应症以血液病、肺动脉高压、癌症为主,表现形式以ActRIIA/B融合蛋白为主;真正进入临床研究的、有计划以肥胖为适应症的ActRII抗体,仅有Versanis/礼来的Bimagrumab和来凯医药的LAE102;后者而言,前面提到BioAge的Azelapra可能是*一个进入临床的apelin激动剂。
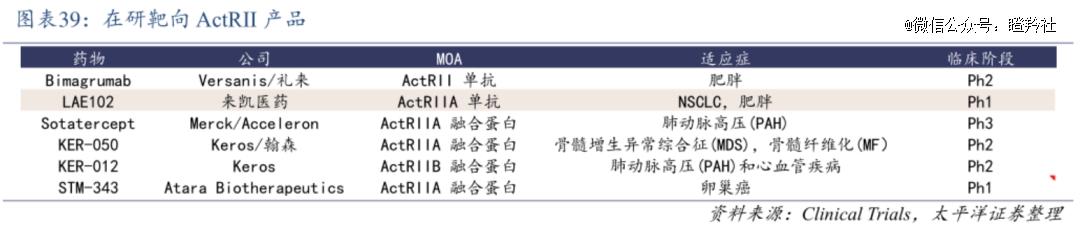
对于国内Biotech来凯医药而言(不止于某家公司,而是针对ActRII靶点开发后来者),LAE102是存在较大突围机会的,原因有几个:
1)礼来收购的Bimagrumab原研为诺华公司,原本针对一种罕见的肌肉萎缩疾病(散发性包涵体肌炎)治疗的中后期临床失败,转而进行减重适应症的研究(后Versanis从诺华手中收购)。也就是说,原本该药物并非以减重适应症为前期研发导向,后来me better分子有很大优化空间;
2)Bimagrumab在安全性上也有优化空间,诺华2021年在JAMA发表的Bimagrumab临床数据显示:其核心不良事件是轻度腹泻(41% vs 11%)和肌肉痉挛(41% vs 3%),尤其是首次给药后腹泻频率最高,后逐渐减少。
3)另外针来凯医药的LAE102,其创始人吕博为Bimagrumab的共同发明者,可能对该靶点有更深的理解,或者对改良该靶点的管线有更强的优势。
除了来凯医药之外,翰森药业也留意到了激活素(ActRII)受体靶点带来的广谱疾病治疗的机会。
2021年12月翰森药业以2000万美金加高达1.705亿美元里程碑从Keros引入KER-050,该产品是一种“工程化的配体捕获体”,由经修饰的TGF-β受体(即激活素受体IIA型)配体结合区域与人源抗体的Fc区域融合而成,用于治疗骨髓增生异常综合征(MDS)和骨髓纤维化患者血细胞减少等领域患者。
对于国内的创新药企业来说,减重药“伴侣”管线是能够获得MNC补全代谢领域布局的热门方向,也是全新的方向,存在巨大的机会。
结语:华创医药从基于肌肉萎缩的抗衰治疗需求、消费者对于塑型的医美需求等分析指出,增肌本身便是有望和减肥相媲美的巨大蓝海市场;而从现已发现的ActRII、apelin等靶点潜力来看,随着癌症、肌肉萎缩疾病、肺动脉高压和代谢等适应症治疗潜力的逐步兑现,上述的展望并非是一句空话。
【本文由投资界合作伙伴微信公众号:瞪羚社授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。




