当大家还在看ADC时这类大分子的主流偶联方式时,有一小分子偶联方式即将改写小分子药物的底层逻辑。
在国外,该疗法的最快管线已经被推进至III期临床,做的也是癌症中*的市场之一——乳腺癌市场。而在国内,创新药一哥也表现出了对该疗法的青睐,其相关管线BGB-16673已经在近日获得了FDA快速通道认证。
PROTAC疗法正在对传统的小分子药物呈现降维打击之势,未来拥有巨大的颠覆传统小分子药物市场逻辑的潜力。
01 PROTAC——降维打击的小分子疗法
PROTAC疗法的生物学底层逻辑是用细胞内的泛素-蛋白酶体蛋白降解机制来实现对目标蛋白的降解。
泛素(简称Ub)是体内的一种用于标记蛋白质的小号蛋白(仅76个氨基酸),经由它标记的蛋白质将经过E1,E2,E3三种泛素酶,完成泛素的激活,转运,最后连接到E3酶上(该酶是特异性识别靶蛋白的酶),通过E3酶,泛素完成和靶蛋白的结合,形成泛素-蛋白复合物。在蛋白完成泛素化后,26S蛋白酶体可以特异性地识别这个带有泛素标签的底物蛋白,进而将其降解。
该过程可以完成细胞内大部分短寿命蛋白质的降解。于是,能够降解特异性蛋白质的PROTAC疗法应运而生。
PROTAC全称为蛋白水解 ‒ 靶向嵌合体 ,其结构由三部分组成:蛋白结合配体、E3泛素连接酶结合配体和linker,其底层逻辑是把目标蛋白通过PROTAC分子和E3泛素酶连接,使得该目标蛋白被打上泛素的标记,然后便会按上问的泛素降解过程形成泛素-蛋白复合物,继而进入26S蛋白酶体完成降解。
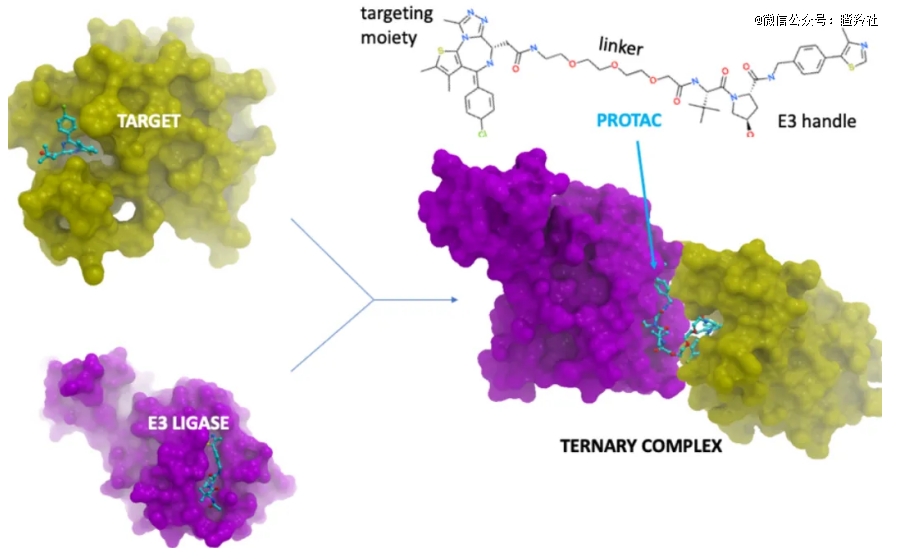
(图源:合联启程GMP)
在该过程中,PROTAC分子可以被循环使用,在完成一个靶蛋白的催化降解后迅速进入另一个靶蛋白的降解过程,因此,PROTAC分子仅仅是作为催化剂的作用而存在。
对于传统小分子药物来说,小分子药物首先必须要找准靶蛋白上的活性位点,亲和力要高,且为了维持活性浓度,必须频率较高去给药。而作为催化剂的PROTAC分子没有这个顾虑,它偶联的靶蛋白靶点不需要考虑活性的问题,只要能够连接便可。
而从这样的逻辑来说,PROTAC分子将对于传统的小分子药物来说,可以看作是一次非常成功的迭代,其相对传统小分子药物的优势如下:
1.小分子药物需要不断用较高的浓度去刺激靶蛋白的活性靶点,但时间一长便会产生耐药性的问题。而作为催化剂的PROTAC而言,不需要传统小分子那样的大剂量不停刺激活性靶点,这样使其耐药性更加难以产生。
2.PROTAC由于不是必须去偶联靶蛋白中的活性位点,因此理论上它将大大拓宽未来对于蛋白质靶点的选择,众多不可成药的靶点未来都有可能被用于PROTAC分子上。
此外,值得一提的是,运用泛素-蛋白酶体蛋白降解机制来开发的疗法并不只有PROTAC,另一项进展较快的疗法是分子胶。虽然都是通过E3酶进行作用,但二者有相当大的差异性。
从优势上说,分子胶的分子量相较于PROTAC而言要更小一些,改结构和优化理化性质更加方便。而PROTAC由于分子量相对较大,可能从传统的成药角度来看,药代动力学特性相对而言可能没有分子胶好。
此外,分子胶可以很好地避免PROTAC的一个重要问题:钩状效应(hook effect)。对于PROTAC而言,当作为中介的PROTAC浓度过高时,它更倾向于和E3或者靶蛋白中的一种形成二元复合物,而不是预期的三元复合物,而三元复合物不形成,预期内的降解就无法发生。该效应对PROTAC的治疗浓度产生了一定的限制。
分子胶很好,它避免了PROTAC的诸多问题,但它目前而言由于太过前沿,对于它的很多机制研究还不是很明确,而导致对分子胶相应分子的筛选机制还不是特别明确,目前筛出来并商业化的分子胶基本都是通过偶然的方式发现的。
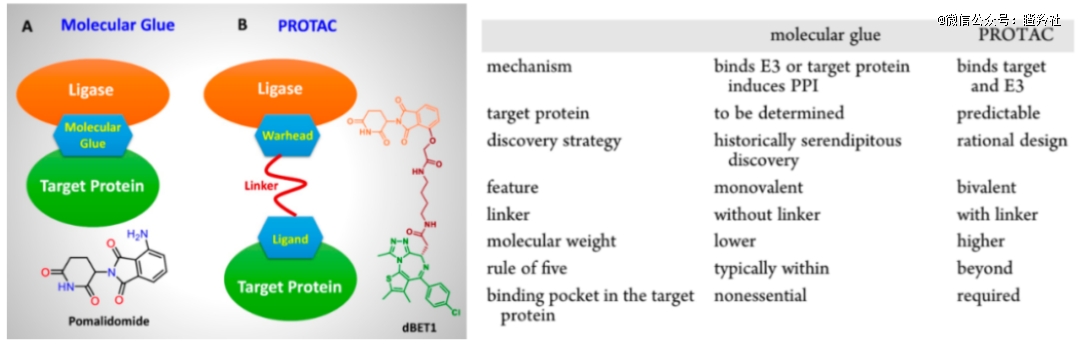
(图源:Dong, G., 2021. Molecular Glues for Targeted Protein Degradation: From Serendipity to Rational Discovery. Journal of Medicinal Chemistry 64.)
从这个角度而言,目前在泛素-蛋白酶体降解途径疗法中,离可以大规模商业化最近的,仍然是PROTAC。
02 即将打开商业化大门的PROTAC先驱
在深耕PROTAC疗法的biotech中,目前距离商业化最近的则是深耕该疗法十余年的Arvinas。
其实从Arvinas的管线布局中也可以看出,开拓者们在肿瘤领域多会选择在乳腺癌和前列腺癌两个瘤种上去进行突破,因为这两种癌症都与性激素密切相关,因此可以通过PROTAC疗法去降解性激素的受体,来达到治疗癌症的目的。
Arvinas在癌症领域进展最快的管线是针对乳腺癌适应症的ARV-471,在乳腺癌中,它主要针对的是ER+/HER2-的分型。乳腺癌的市场规模有目共睹,根据最新的映恩生物招股书的数据,全球乳腺癌人数在2023年达到了240.8万人,预计将于2032年达到319.6万人,这其中,HER2-/ER+分型占所有乳腺癌的45-50%,根据Arvinas自身的说法,该分型的乳腺癌市场达到了170亿美元。
ER就是雌激素受体,对于雌激素受体阳性的乳腺癌患者而言,雌激素拮抗治疗是小分子药物中最为常见的治疗手段。在这其中,一线疗法可以用AI(芳香酶抑制剂)以及前线的CDK4/6抑制剂,例如哌柏西利这种早期获批的CDK4/6i,而二线治疗则可以使用氟维司群和新型的CDK4/6抑制剂例如瑞博西尼(Ribociclib)联用治疗;但对于小分子药物(例如CDK4/6抑制剂),耐药仍然是目前的大问题,这与前文所述的小分子药物底层逻辑相关。
而ARV-471这条管线来说,其早期的临床试验设计则主要也是在针对小分子药物耐药的后线治疗来设计的。今年ESMO乳腺癌年度大会,它的临床Ib期结果较为全面地展现了出来。
患者基线上,其患者中87%接受过CDK4/6抑制剂的治疗,45.7%的患者接受过化疗,80%的患者接受过雌激素抑制剂氟维司群的治疗,在31名患者中展现出了非常惊艳的疗效。其联用K药时,评估后的ORR达到了41.9%,这个数字超过了目前众多CDK4/6抑制剂耐药后的后线疗法。
目前公布的临床数据中,Ribociclib联合ET化疗方案的ORR是20%(n=35,临床样本量接近),而患者基线二者也较为相似,都是为了处理CDK4/6抑制剂耐药后的情况,该次试验中患者全部接受了CDK4/6抑制剂的治疗,不过接受化疗和氟维司群的患者比例远远比AV-471的早期临床少:接受化疗的比例为6.7%,接受氟维司群的比例为16.8%。
在患者基线相差较大的情况下,ARV-471仍然达到了两倍多的ORR,真正实现了对传统小分子疗法的降维打击。在另外的重要指标例如mPFS上,同样达到了两倍多的差距,ARV-471的这mPFS达到了11.2个月,而Ribociclib的此前研究的数字是5.3个月。
其它疗法,例如帕博西尼联用ET化疗等,更是没有疗效上的可比性。
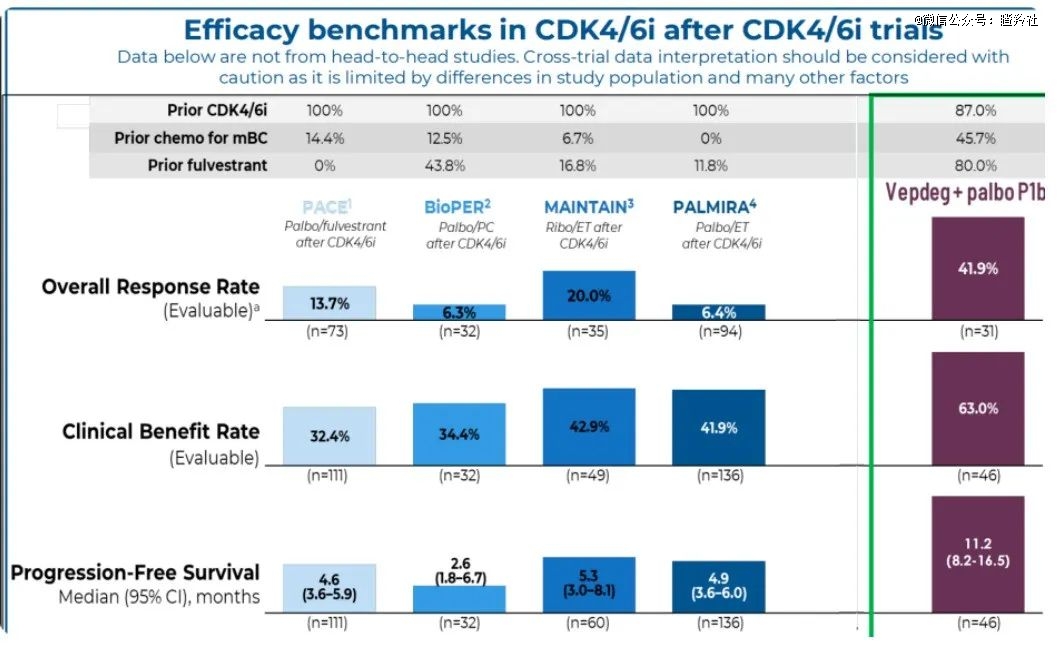
(图源:Arvinas官网)
从目前Arvinas的预期来看,虽然早期该药是专门针对后线治疗去开展临床的,但其也已经在一线治疗上早早开始布局:目前,该药联用帕博西尼的一线治疗ER+/HER2-局部晚期乳腺癌的III期临床试验已经在进行中,而后线治疗则是重头戏,既包括单药治疗,也包括联用小分子靶向药物依维莫司,联用新一代CDK4/6抑制剂PF-07220060(Atirmociclib)等。
作为一个和CDK4/6抑制剂机制完全不同的乳腺癌药物,其在CDK4/6抑制剂的同质化内卷中脱颖而出,从远期看,它有着非常高的天花板;从近期看,它在年底到明年初有关键数据读出,是一个股价的关键催化机会。
而另一款关于肿瘤的重磅管线则是针对前列腺癌的ARV-766。该药是从PROTAC疗法的元老级药物ARV-110基础上迭代而来,ARV-110可以看作是一个试错品,由于局限性较大,目前已经暂停管线进度推进。
ARV-766在其基础上加以改进。结构上,比较关键的改进是将氟取代的沙利度胺替换为氟取代的苯甲酰胺,这一结构上的改进增强了分子的选择性以及在血浆中的稳定性。
而结构上的改进拓宽了该药物的适应症范围:ARV-110不能应对AR L702H突变的情况,而ARV-766成功突破了该困境,增加了可用药人群的数量。根据2023年8月公布的1/2期临床试验数据,3名雄激素受体(AR)H875/T878/L702H突变患者中,前列腺特异性抗原(PSA)水平降幅均大于50%,实现了突变患者疗效上质的突破。
当然,ARV-766目前还需要样本量更大的临床去验证。但值得一提的是,MNC诺华对该管线相当看好,今年4月,诺华直接付了预付款1.5亿美元,后续里程碑付款更是达到10.1亿美元,就为拿下ARV-766与另一款处于临床前的前列腺癌药物在全球开发和商业化的权益。
除了先驱Arvinas之外,Nurix以及Kymara等早期biotech也值得关注。
Nurix做的PROTAC主要靶向BTK,针对的是各式各样的B细胞血液瘤,并且其管线目前处于非常早期的阶段,进展最快的NX-5948和NX-2127目前处于临床1b期。NX-5948今年得到了较大的进展,6月份发布了其针对CLL(慢性淋巴细胞白血病)较为积极的早期临床数据。
在Ia期试验中,患者接受过的中位治疗为4线,包括共价BTK抑制剂(96.8%)、BCL-2抑制剂(90.3%)和非共价BTK抑制剂(25.8%)等。在可评估疗效的CLL患者(n=26)中,接受所有剂量水平NX-5948治疗患者的ORR达到了69.2%,也是非常值得期待的CLL后线治疗的新星。

(来源:Nurix公开PPT)
Kymera目前进展最快的管线KT-474已经进展到了临床II期,其主要针对自免适应症。目前两条个适应症为化脓性汗腺炎(HS)和特应性皮炎(AD)。其针对KT-474与赛诺菲早在2020年就展开了全面的合作,赛诺菲潜在的支付金额高达20亿美元。
今年7月8日,Kymera宣布在IDRC审查数据之后,其partner赛诺菲决定扩大KT-474治疗化脓性汗腺炎、特应性皮炎两项二期临床试验,以求更快推进到关键临床。在之后的一个礼拜,股价迎来了非常迅猛的大涨,从7月8号的30美元上涨至7月16号的45美元。
PROTAC的想象力空间,在美股股价上体现的非常充分。
03 国内的突破性进展
国内方面,目前药企们也正在紧锣密鼓地追赶。
不久前百济神州官宣的BGB-16673无疑是国内PROTAC领域一个巨大的突破。百济本身就是BTK小分子抑制剂深耕十余年的老玩家,以其现有的技术平台为根基去发展靶向BTK的PROTAC,基础上是打得较为牢固的。
在2021年的研发日上,百济公布了其PROTAC平台——CDAC平台。根据百济神州的阐述,该平台相较于其它PROTAC平台的差异性优势在于其能够利用更加广泛的E3连接酶,从而达到减轻DLT(剂量依赖性毒性)的效果,其对耐药性的解决方面也有进一步的提升,此外,也进一步拓展了潜在靶点范围。
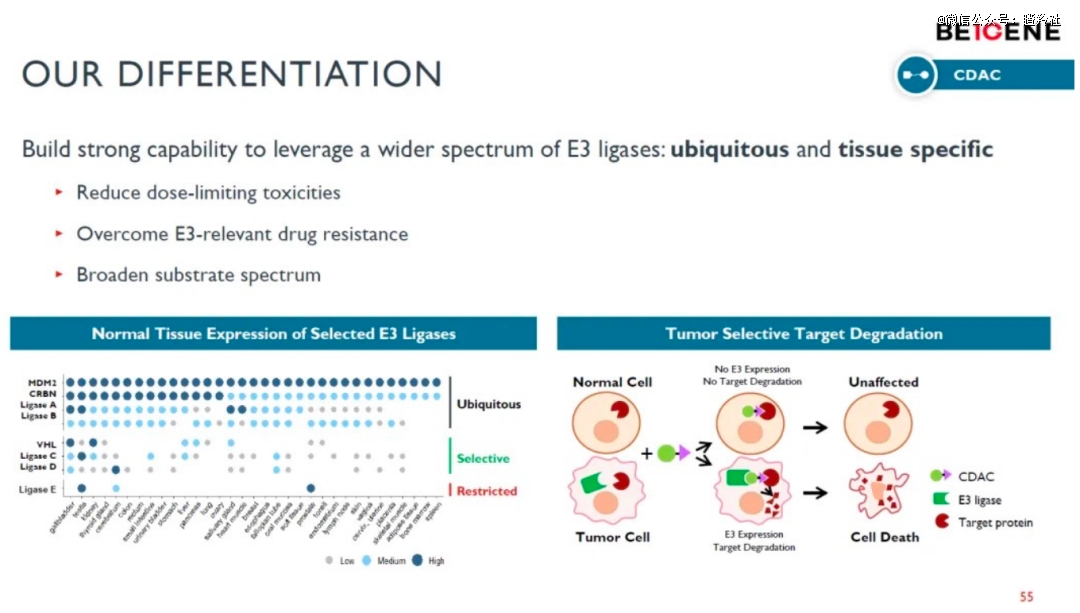
(图源:百济2021年研发日PPT)
而BGB-16673就是百济利用该平台开发出的*条PROTAC管线,主要目的是针对BTK小分子抑制剂耐药的后线治疗问题。
由于其靶点和适应症与Nurix的NX-5948相类似,因此二者可以进行一定的非头对头比较。从BGB-16673的临床I期剂量递增试验的初步数据来看,其在CLL/SLL适应症中的表现非常不错,患者(n=10)基线BTK抑制剂耐药的情况下,它的ORR达到了70%,该数据与上文的NX-5948疗效相当。
后续的大样本临床中,两条管线将进行更为激烈的角逐。
另一家Biotech则是深耕PROTAC技术多年的海创药业,其在2016年就建立了自己的PROTAC技术平台,目前主要深耕的适应症为前列腺癌。
海创药业PROTAC方面核心的管线是HP518,也是国内*进入临床阶段的针对AR的PROTAC药物。其于2023年11月获NMPA批准进入临床,目前该管线获得了中国,美国和澳大利亚三地的临床试验批准。
除了口服的AR PROTAC药物外,还有药企开发出了外用的AR PROTAC疗法。
开拓药业的GT20029用于治疗雄激素性脱发和痤疮,通过降解雄激素受体蛋白来达到治疗雄性激素过盛导致脱发的问题。GT20029也是*进入临床的外用PROTAC化合物。
今年4月,该管线在脱发适应症上达到了II期临床试验终点,从*剂量的1.0% 浓度且一周两次给药剂量组的效果来看, TAHC(区域内头发计数的指标)较基线增加了 11.94 根毛发/cm²,比安慰剂多了 7.36 根毛发/cm²。
但非口服的局部给药制剂究竟能不能走通,目前而言是个有待商榷的话题。从临床II期试验设计来看,其临床设计主要终点为12周目标区域内非毳毛数量,这个时间太过短暂,目前需要的是III期临床中更长周期随访的验证,观察期达到平台期的时间。
不得不说,这是PROTAC技术在一个意想不到领域上的出色应用,真正做到了在AR降解剂上的差异化竞争。
结语:PROTAC疗法的意义主要在于面对目前小分子同质化内卷的困局上打开了一扇新的大门,带来了后线治疗的全新想象力。此外,该疗法目前来看并不只是局限于肿瘤,其想象力空间非常巨大,甚至连外用用于脱发都可以到达III期临床。现在适应症的挖掘上仅仅是冰山一角,未来随着AIDD靶点筛选速度的大大提升,PROTAC疗法的适应症领域也将会得到相当大程度的继续拓展。
【本文由投资界合作伙伴微信公众号:瞪羚社授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。





