时值年末,国产基因测序仪行业迎来重磅政策。
12月初,财政部发布《关于政府采购领域本国产品标准及实施政策有关事项的通知(征求意见稿)》(以下简称《征求意见稿》)向社会公开征求意见的通知。《征求意见稿》明确在政府采购活动中,如果既有本国产品,又有非本国产品参与竞争的,对本国产品的报价给予20%的价格扣除,用扣除后的价格参与评审。此外,如果采购项目或者采购包中包含多种产品,供应商提供的符合本国产品标准的产品成本之和占该供应商提供产品的成本总和80%以上的,对该供应商提供的产品整体给予20%的价格扣除,用扣除后的价格参与评审。
这意味着,在政府采购环节,国产基因测序仪将与进口品牌拉开价格差距。在基因测序仪的商业化过程中,政府采购是主要的落地场景之一,而显著的价格差异,无疑让国产品牌多了一成胜算。不过,在这份《征求意见稿》中,对本国产品的定义做出了细致规定,让市场上不少基因测序仪的身份可能不保。
最高国产门槛
根据《征求意见稿》,本国产品需要同时符合产品在中国境内生产、产品在中国境内生产的组件成本占比达到规定比例、符合对特定产品的关键组件、关键工序等要求等三大标准。三大标准的后两条,为本国产品划定了极高的门槛。
具体而言,产品在中国境内生产,意味着产品应当在中国境内生产,即在中国关境内实现从原材料、组件到产品的属性改变。其中,属性改变是指经过制造、加工或者组装等工序,产生完全不同于原材料、组件的新产品,并具有新的名称和特征(用途)。对于海外品牌而言,产品在境内生产的要求,相对容易通过迂回的方式实现。
值得注意的是,作为本国产品标准的第二条和第三条,《征求意见稿》要求,产品在中国境内生产的组件成本占产品总成本的比例要达到规定标准,并且产品的关键组件在中国境内生产、关键工序在中国境内完成。这就将国产的高标准限定死,是真国产和假国产最严格的区分。现阶段,针对各类产品的规定比例还没有明确,财政部会同相关部门根据产业发展情况,在广泛征求意见的基础上,分产品确定在中国境内生产的组件成本具体占比要求。
作为生命科学工具皇冠上的明珠,高通量基因测序仪的生产涉及光学、机械、电子、流体、软件、算法等多个模块。有从业者分析,由于高通量基因测序仪的供应链体系十分复杂,如果过分强调组件的国产化,可能由于国内供应链生态成熟度低,导致终端基因测序仪产能的衰减。
现阶段,尽管部分精密光学器件、流体器件和晶圆的研发生产难度较高,仍需依赖进口,但整体来看,国产高通量测序仪在多个模块上具备了较高的国产化水平。换言之,这种标准最严的国产定义,已经有国产基因测序仪可以实现。
具体而言,光学模块负责高精度成像和信号检测,通过捕捉荧光信号或电流信号,将测序过程中的数据转化为可读的序列信息。目前,华大智造等企业已在光学系统上取得突破,比如,DNBSEQ-T7测序仪实现了高分辨率成像系统,并且相关光学元件逐步实现国产化。机械模块提供高速、高精度的运动控制和定位能力,确保测序仪在运行过程中保持稳定性和精确性。现阶段,华大智造的DNBSEQ-T7测序仪、赛陆医疗的Salus Pro测序仪等,均实现了这部分组件的国产化。
电子模块包括高精度、快响应的温度控制系统和电子主控系统,负责仪器的整体电气控制和数据处理,确保测序过程的高效性和稳定性。流体模块涉及高精度微量移液系统、低替代比高均匀性流路系统设计以及旁路防污染液路系统设计,确保样本在测序过程中的精确处理和防止污染。当前,华大智造的DNBSEQ-T7测序仪在流体模块上逐步实现国产化,赛陆医疗的Salus Pro测序仪也通过微流控技术,减少了对复杂光学系统的依赖。
软件和算法模块负责测序数据的实时处理和分析,以及仪器的故障诊断和维护,通过复杂的计算方法提高测序数据的准确性和可靠性。现阶段,算法模块华大智造的DNBSEQ-T7测序仪在软件和算法模块上也逐步实现国产化。真迈生物的FASTASeq 300测序仪实现了全平台国产化,并在碱基识别算法等方面取得创新。
从某种意义上讲,经过以往10年从无到有的探索,国内基因测序仪行业在一定程度上摆脱了对海外技术和组件的依赖,部分头部企业已经具备了完全国产的能力。此次《征求意见稿》的发布,为这些国产基因测序仪品牌构筑了强大的竞争壁垒。在商业化全面爆发的第三年,国产基因测序仪终于拿到了身份层面的最强加持。
被优惠政策推着走
在国内,由于基因测序涉及人类遗传信息这类高度敏感的数据,国产替代的需求一直存在。在国产基因测序仪商业化的过程中,来自政策端的优惠扶持,形成了极大助力。这也是基因测序仪的国产身份具有极高重要性的原因。
总体而言,面向国产基因测序仪的政策优惠覆盖从研发、生产到市场准入的各个环节,包括研发生产阶段的审评审批绿色通道、知识产权保护及资金层面支持,市场准入阶段的进口限制、政府采购优惠、税收优惠等。
研发生产方面,早在2018年4月,国家发改委等8部委就发布了《关于促进首台(套)重大技术装备示范应用的意见》,旨在解决首台高通量基因测序仪难采购的问题,提出对于对首台套产品的核心关键专利申请,依法给予优先审查支持,提高审查质量和效率,增强授权及时性和专利权稳定性,并加大重大技术装备研发创新的资金支持力度,对从事重大技术装备研发制造的企业,按现行税收政策规定享受企业所得税税前加计扣除优惠,经认定为高新技术企业的,减按15%税率征收企业所得税等。由此,极大激发了基因测序仪自主研发的活力。
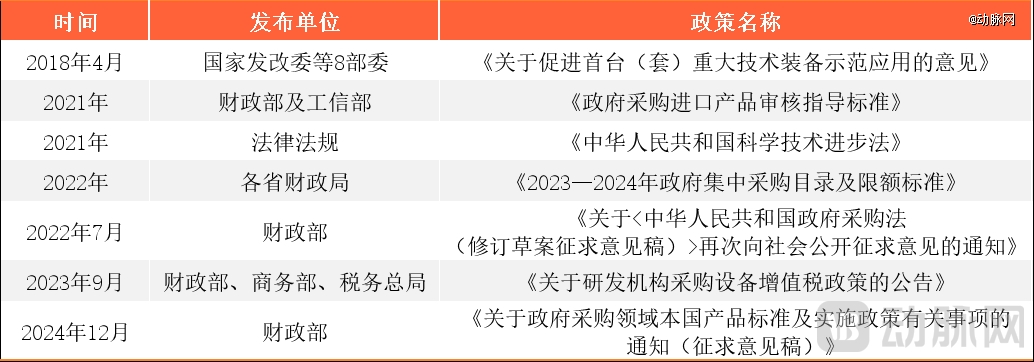
进口限制方面,2021年,财政部和工信部联合发布《政府采购进口产品审核指导标准》,要求二代测序平台100%国产采购。同年,《中华人民共和国科学技术进步法》修订发布,明确政府采购应当优先购买满足功能、质量等指标要求的国产仪器,逐步提高公立医疗机构国产设备配置水平。
此外,2022年,省级财政局陆续发布《2023—2024年政府集中采购目录及限额标准》,强调政府采购应当采购本国货物、工程和服务,确需采购进口产品的,采购人应当按照有关规定严格履行审核程序,具体到医疗器械领域,公立医疗卫生机构采购进口医疗设备,将要统一由行业主管部门进行专家论证和初步审核。
政府采购优惠方面,除了本次财政部提出的20%价格扣除外,2022年7月,财政部印发《关于〈中华人民共和国政府采购法(修订草案征求意见稿)〉再次向社会公开征求意见的通知》,明确除在中国境内无法获取或者无法以合理的商业条件获取、为在中国境外使用而采购的、其他法律法规另有规定外,政府采购应当采购本国货物、工程和服务,在法律层面明确将“支持本国产业”作为一项政府采购政策。
税收优惠方面,2023年9月,财政部、商务部、税务总局联合发布《关于研发机构采购设备增值税政策的公告》,明确为鼓励科学研究和技术开发,继续对内资研发机构和外资研发中心采购国产设备全额退还增值税。
由此可见,国产基因测序仪行业在商业化的早期,几乎是被政策优惠推着走。根据illumina此前发布的2024年半年财报,在2024年上半年,illumina国内新装机数量持续下降,结合华大智造发布的同期财报,其自主品牌的基因测序仪新装机数量,已经超过了illumina。其中,还包括华大智造与中游基因测序服务商合作推出的设备装机数量。对于国产基因测序仪厂商而言,国产身份,是对抗海外品牌先发优势的有力武器。
海外品牌已经开始反击
自2014年7月,国内*二代基因测序产品获批上市以来,国内已经有数十款基因测序仪获批上市。根据核心的测序化学体系来源不同,这些基因测序仪可以分为2大类,即贴牌设备和自研设备。其中,贴牌设备又进一步分为进口贴牌设备和国产贴牌设备。现阶段,市场上品类最多的基因测序仪,是国产贴牌设备,但应用最广泛的,则是进口贴牌设备。
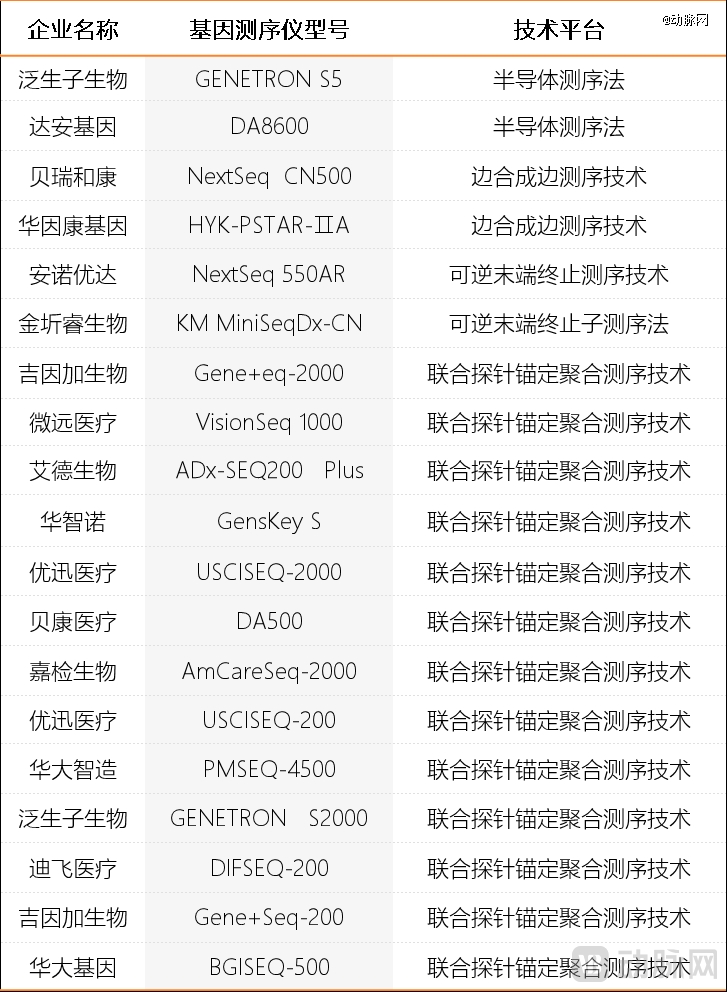
2014年7月,原国家食药监总局经审查,批准了华大基因的BGISEQ-1000基因测序仪、BGISEQ-100基因测序仪及相关试剂盒上市,用于胎儿染色体非整倍体检测。据了解,这两款设备的测序化学体系,分别来自华大基因收购的Complete Genomic,和Life Technologies的Ion Torrent平台授权。此后,达安基因DA8600测序仪、博奥生物BioelectronSeq 4000测序仪、贝瑞基因NextSeq CN500测序仪等也相继获批上市,相应的测序化学体系也分别来自海外品牌。
有从业者分析,国内基因测序服务商的测序仪贴牌史,就是半部国产基因测序仪的发展史。在基因测序仪实现全面国产前,中游的基因测序服务商掌握大量的临床资源,却缺少硬件开发能力,容易被上游牵制,而上游的海外基因测序仪品牌想要进军国内市场,又苦于准入条件的限制。两者互补,推动了基因测序仪贴牌生产的短暂繁荣。
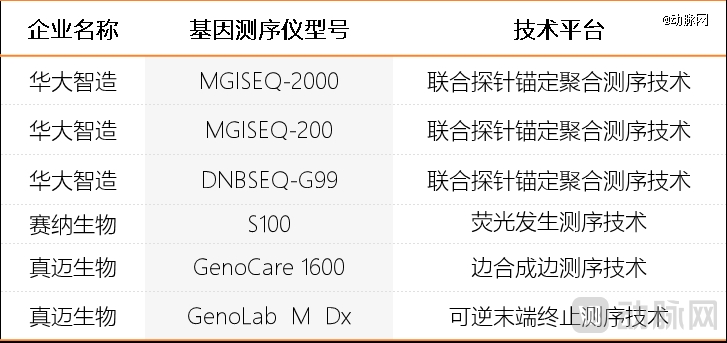
2015年,华大智造推出了首台商业化的国产基因测序仪,并迅速推动与中游测序服务商的开发合作。基因加生物、泛生子、微远基因等在肿瘤伴随诊断、病原微生物检测等领域占据较大市场份额的测序服务商,纷纷与华大智造合作,推出了国产贴牌基因测序仪。
此后,随着国产基因测序仪阵营的持续扩容,进口贴牌基因测序仪将成为历史。不过,现阶段,从中游服务商在特定细分市场的占有率看,进口贴牌基因测序仪仍然是国产市场的主力。可以预见,随着《征求意见稿》的发布和落地,进口贴牌基因测序仪或将失去原来的国产身份,贴牌基因测序仪市场可能面临洗牌。
当然,进口基因测序品牌的反扑之势,不可小觑。近年来,illumina不断加大本土化力度。2023年8月末,illumina宣布,在中国本土生产制造基地的首批系列产品已成功完成交付,包括桌面式测序仪NextSeqTM 2000、超大规模量产型测序平台NovaSeqTM 6000Dx-CN以及5款CN NextSeqTM 550Dx临床应用测序试剂等,正式面向中国客户全面接受预订。据了解,这是illumina全球第三个区域生产中心,于2022年8月25日正式启用,并计划五年内逐步实现高端基因测序仪及耗材全面本土化生产。
此外,Life Technologies的母公司赛默飞也积极在国内投资建厂,陆续将多款产品的生产线搬来本土生产,后续是否会涉及基因测序仪产线,还不得而知。不过,对于本土化生产的海外品牌,《征求意见稿》也提出了更高要求,将多种细微操作排除在属性改变之外。《征求意见稿》明确,属性改变不包括为确保产品在运输或者储存期间保持某种状态而进行的操作、为产品运输或者销售进行的包装或者展示、在产品或者其包装上粘贴或者印刷品牌、标志、标识以及其他用于区别的标记、简单的上漆、磨光和分装等细微操作。
如今,基因测序早已从最*的科研技术,转变为临床医学的重要工具。而基因测序仪的国产化从纯粹的技术突破,走向与全球*品牌的市场火拼。我们也希望看到更多的国产基因测序仪,在政策优惠和产品本身的加持下,可以成为基因测序市场的真正主力。
【本文由投资界合作伙伴动脉网授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






