2024年,选择拥抱美国纳斯达克成为了不少国内Biotech资本路径选择,也被市场投资人认为是“上岸”的另一种方式。
严格意义上来说,选择美股意味着Biotech要面临更专业、更残酷的资本环境,如果自身核心产品处于临床早期,必须拿出过硬的数据才能继续享受美股对待生科行业“友好”的投融资环境,要说是“上岸”显然是太早的。
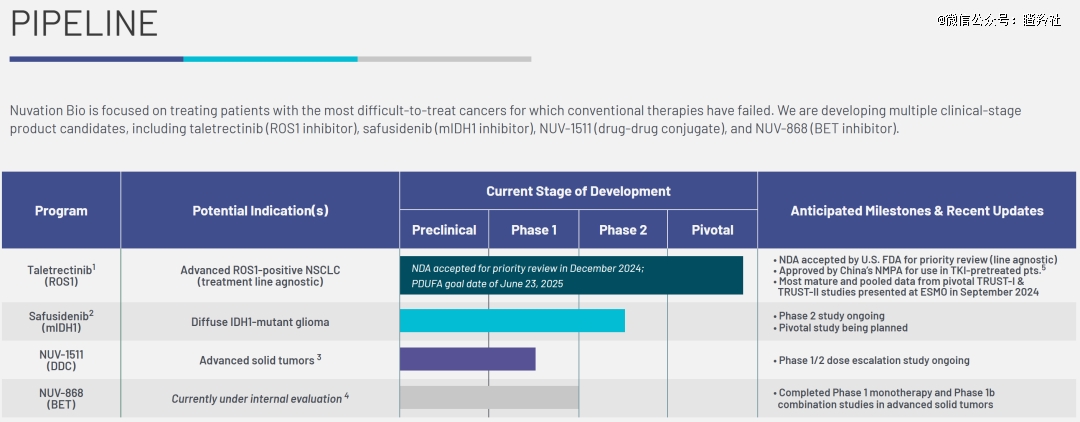
而有那么一家Biotech,即将收获一款商业化产品,他就是早前与Nuvation Bio合并的葆元医药。
早前,信达生物宣布新一代ROS1酪氨酸激酶抑制剂他雷替尼(Taletrectinib)获得NMPA批准上市,用于经ROS1-TKI治疗后进展的ROS1阳性局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗,成为公司第13款商业化产品,而他雷替尼的原研方正是葆元医药。
2024年12月底,Nuvation Bio宣布他雷替尼NDA已获FDA受理并予以优先审评,用于治疗ROS1阳性晚期NSCLC患者,该NDA的处方药使用者费用法案(PDUFA)日期为2025年6月23日。
如果明年6月顺利获批,Nuvation Bio将成为在美国有商业化产品的Biotech,当前公司大约有5.5亿美元现金及短期投资,最新市值为9.73亿美元。
值得一提的,Nuvation Bio的实控人David Hung也是一个传奇人物,其曾经创立的Medivation在2016年被辉瑞以近140亿美元成功收购。
01
BIC的ROS1抑制剂商业化前景可观
他雷替尼是新一代的ROS1小分子抑制剂,其主要特点在于该药可穿过血脑屏障(对脑部病灶有治疗效果)、针对ROS1-TKI(克唑替尼)耐药后患者仍然有效,同时安全性和耐受性良好(相比其他ROS1药物使用过程中因不良反应中止治疗或者减少剂量的比例较低)。
ROS1和ALK一样都属于胰岛素样受体酪氨酸激酶超家族成员,其参与人体多个通路的调控,进而影响细胞的存活和增殖。ROS1基因在非小细胞肺癌(NSCLC)被发现最早可追溯到2007年,在非小细胞肺癌中突变率并不高(全球阳性率为1%-3%);ROS1重排在中国作为致癌驱动基因改变,大约占晚期非小细胞肺癌患者的2%至3%,NTRK大约占其它晚期实体瘤患者的0.5%。
不过,ROS1融合被视为NSCLC中的一个经典的“钻石突变”,一方面其被发现以来相关靶向药不断面市,另一方面ROS1重排肺癌患者预后较好,总生存期较长。
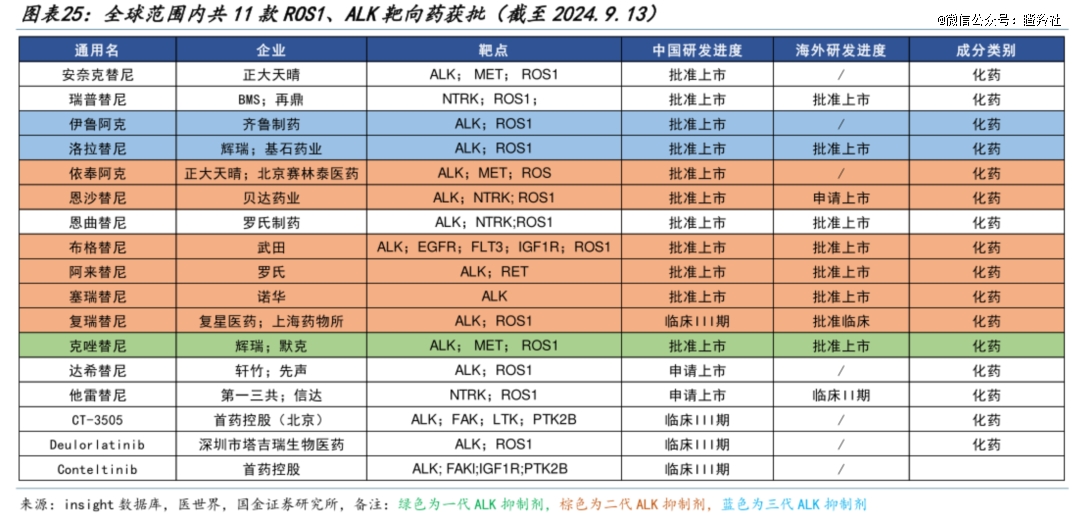
克唑替尼作为*代ALK抑制剂,长期霸占ROS1阳性晚期NSCLC一线治疗推荐,疗效已经充分验证;2020年的一项大型多中心回顾性研究显示克唑替尼一线治疗ROS1重排晚期NSCLC患者的疗效(一线占比100%) :中位PFS达23个月,中位OS达60个月。
克唑替尼效果很好,但未满足临床需求仍然存在,急需新一代ROS1抑制剂补位。
目前针对ROS1阳性非小细胞癌患者,特别是其中超过三分之一的患者发生脑转移,以及超过一半以上的患者进展至耐药突变,目前这部分患者治疗选择有限。
BMS/再鼎医药的瑞普替尼是其中一个选择,其二期研究显示其治疗初治患者mPFS达35.7个月,优于NCCN指南中两个一线推荐方案恩曲替尼和克唑替尼。
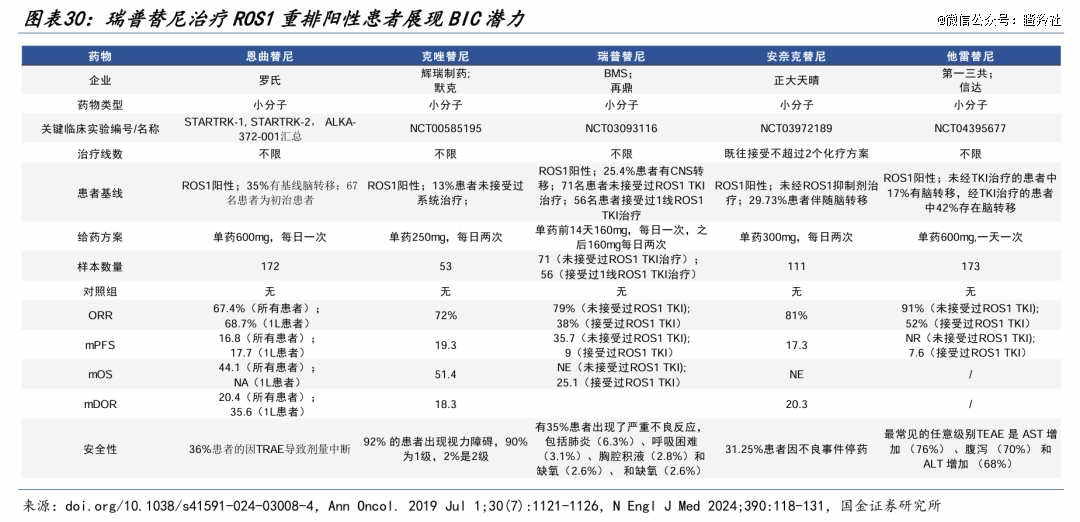
Nuvation Bio(葆元医药)的他雷替尼是新一代ROS1抑制剂中的潜在Best in class。
他雷替尼在国内的获批、FDA优先审评及NDA受理是基于两项II期研究(TRUST-I和TRUST-II)的汇总分析结果,TRUST-I是一项中国二期单臂注册临床,主要评估塔雷替尼在未接受过TKI治疗或先前接受过克唑替尼治疗的晚期ROS1阳性NSCLC患者中的疗效;TRUST-II则是一项全球性的扩展试验,扩大人种范围探索他雷替尼的疗效和安全性,而该项试验更探索了他雷替尼在脑转移晚期ROS1阳性NSCLC患者的疗效。
Nuvation Bio的两项关键研究TRUST-I和TRUST-II在ESMO上展示的汇总结果显示,中位PFS达46个月,中位DOR达44个月,接近4年,非头对头数据对比下优于瑞普替尼的34个月DOR和36个月PFS,堪称同类*。
安全性层面,他雷替尼延续了在2023 ESMO大会上公布的结果,三级以上的不良事件包括:观察到一些AST和ALT升高(肝功能指标,8-10%),胃肠道相关事件(1-2%)。29%的患者因治疗相关不良事件需要减少剂量,6.5%的患者因TEAE停药。对比瑞普替尼29%三级不良事件的发生率,他雷替尼安全性潜力更大。
基于他雷替尼在ROS1阳性NSCLC初治患者中长达近4年的PFS及良好的耐受性,Jefferies测算他雷替尼销售峰值可能超过10亿美元。
而这样的销售预测,不仅源于ROS1阳性NSCLC患者在他雷替尼治疗下的长生存期,并且基于*代ROS1药物过去在该领域大约5亿美元的年销售额、BMS/再鼎医药的瑞普替尼6-8亿美元销售峰值预测(初治患者36个月PFS)。
02
IDH1的新故事
ROS1之后,Nuvation Bio下一个催化也源自于合并的葆元医药,其mIDH1抑制剂正在进行一项针对2级和3级IDH1突变神经胶质瘤患者的全球临床二期。
IDH1是参与三羧酸循环的重要酶,IDH1基因突变会导致细胞内促癌的代谢产物a-羟戊二酸的增加,已有大量研究证实其突变与多种肿瘤的发生、发展、转移和预后有密切关系。
证据显示,目前IDH1突变率高且全球主要开发的肿瘤适应症分别为胶质瘤、IDH突变的急性髓系白血病(AML)和IDH1突变的分化软骨肉瘤。
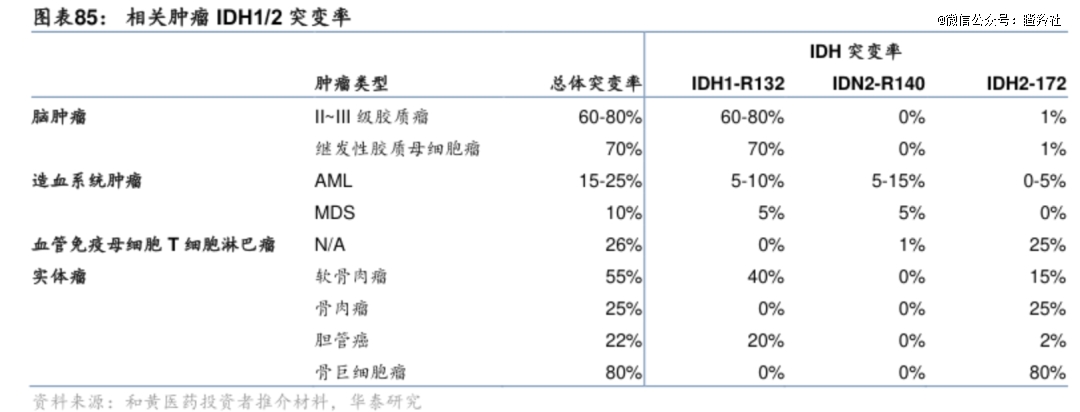
对于Nuvation Bio来说,IDH1抑制剂的故事可能会比ROS1更性感。
据Jefferies数据显示,带IDH1突变的胶质瘤在美国有1.3~1.8万名患者,而ROS1阳性的晚期NSCLC患者仅有2~4千名患者。

目前全球已获批的IDH1靶向药物有三款,艾伏尼布、Olutasidenib均获批用于治疗IDH1突变AML患者,而施雅维的IDH1/2抑制剂Vorasidenib是FDA批准的*且*一款用于治疗IDH突变2级胶质瘤的靶向药物,于2024年8获批。
Vorasidenib在针对治疗带IDH1/2突变二级胶质瘤患者的INDIGO三期研究数据显示,Vorasidenib组和安慰剂组的中位PFS分别为27.7个月、11.1个月,展现出了较为显著的疗效。安全层面,Vorasidenib组和安慰剂组≥3级不良反应的发生率分别为22.8%和13.5%,其中Vorasidenib组患者肝损伤指标升高、腹泻等患者比例显著高于安慰剂组;Vorasidenib组治疗和安慰剂组停止、剂量减少和剂量中断的不良事件发生率分别为6.3% vs 1.2%、10.8% vs 3.1%和29.9% vs 22.7%。
Nuvation Bio的mIDH1抑制剂Safusidenib,有望向Vorasidenib发起冲击。Safusidenib一项针对胶质瘤患者的一期临床数据显示(入组患者范围在2~4级胶质瘤),在12例非强化胶质瘤患者和35例强化胶质瘤患者中,非强化和强化患者的客观缓解率(ORR)分别为33%和17%。
尽管Safusidenib的早期数据ORR对比Vorasidenib同期临床有所逊色,但Safusidenib如果能在2级脑胶质瘤后更晚期患者做出优异疗效,在进军Vorasidenib的领地也是一个不错的策略。
03
一款好药物,会获得市场正向回馈
在海外市场,我们可以看到不少随着自身核心产品商业化逐渐放量,市值节节攀升的Biotech公司,其背后均有与国内公司合作的影子。
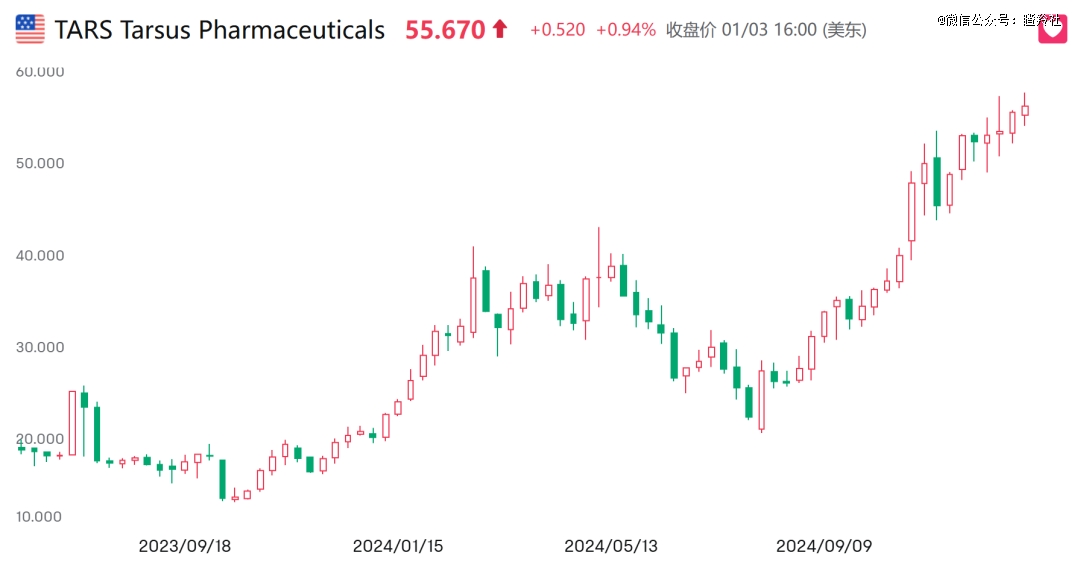
比如在眼科领域, Tarsus Pharmaceuticals治疗蠕形螨性睑缘炎的XDEMVY滴眼液在2023年7月获得FDA批准, 2024年前三个季度的销售额分别为2470万美元、4080万美元、4500万美元,不断超出市场预期,公司股价年内涨幅远超1倍。该药的大中华区权益在2024年3月,被远大医药花费1500万美元引进。
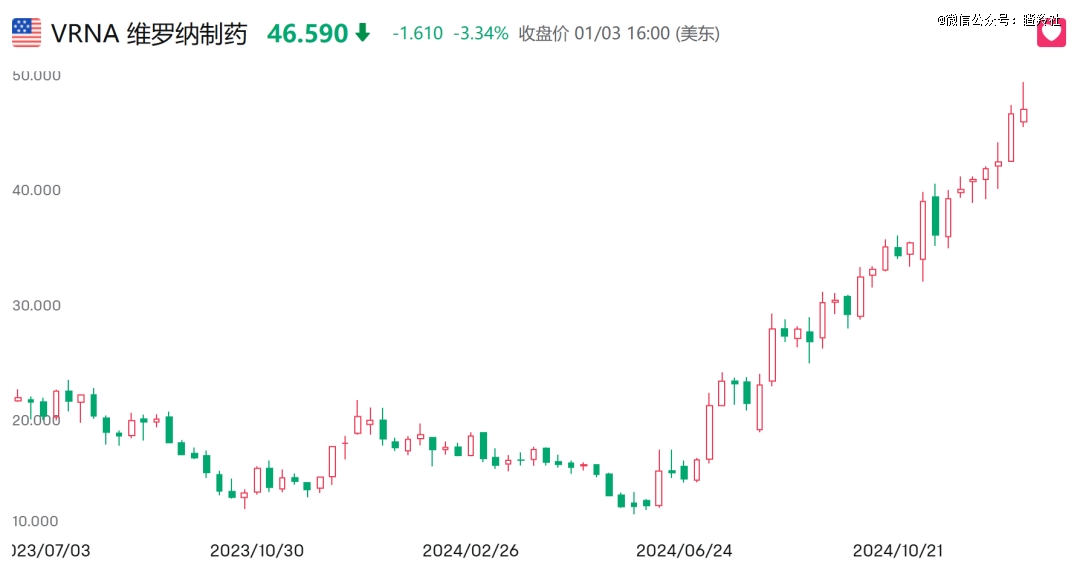
在呼吸疾病领域,维罗纳制药的慢性肺阻塞吸入式新药Ensifentrine在2024年6月底获得FDA的批准,这是近十几年来*COPD新药。该药在2024Q3正式商业化,*季度销售560万美元(超出市场200万美元预期),另外在近期外资机构的市场调研中发现该药物在Q4的使用量攀升(预计2024Q4销售可能达到1700万美元),并且有望在2025年进一步加速,这为该药冲击10-15亿美元销售峰值提供了强劲的支持。
维罗纳制药的股价在2024年6月以来上涨了2.7倍,另外2021年6月,优锐医药以2500美元首付和自身母公司1500万美元的股权引入了Ensifentrine大中华区权益。
上述两个案例在海外并不罕见,比较经典的例子还有华东医药合作伙伴Arcutis Biotherapeutics、Kiniksa Pharmaceuticals,分别凭借着特应性皮炎&银屑病创新制剂、复发性心包炎新药商业化放量带动了自身市值的持续上涨。
未来或许更加值得期待的是像康方生物和Summit这样的合作案例,海外Biotech凭借国产分子的临床进展和商业化推动其市场价值不断兑现,那么Nuvation Bio会是全新的例子吗?
结语:或许投资者应该深刻意识到,尽然国内支付端体系不够完善无法完全支持国产创新药兑现其蕴含的所有价值,但从近年来日益井喷的出海事件能够看出,国产创新药正在支棱起来,未来通过出海仍有大量的机会,无论是中国资本市场,还是海外。
【本文由投资界合作伙伴微信公众号:瞪羚社授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。






